REPORTE DE CASO
Tumor miofibroblástico inflamatorio gástrico, reporte de caso con énfasis en sus características clínico-patológicas
Gastric inflammatory myofibroblastic tumor, a case report with emphasis on its clinicopathologic features
Pablo Ortega-Espinosa 1 2; Luis Jaramillo 3; Hernán Garrido Cisneros 3
- Ortega Pathology Lab, Loja, Ecuador
- Hospital Clínica San Agustín, Loja, Ecuador
- MediHospital, Loja, Ecuador
A. ORCID: 0000-0001-6855-8252
B. ORCID: 0000-0003-3124-422X
C. ORCID: 0000-0003-4934-7622
Palabras Clave: Tumor miofibroblástico inflamatorio, estómago, inmunohistoquímica
Keywords: Inflammatory myofibroblastic tumor, stomach, immunohistochemistry
Fecha recepción: 17-07-2024
Fecha aceptación: 26-08-2024
Fecha publicación: 27-09-2024
DOI: 10.65183/revind.e12.01
Resumen
El tumor miofibroblástico inflamatorio es una neoplasia poco común en el estómago, a menudo se diagnostica en niños y adultos jóvenes. Aunque en la mayoría de los casos se comporta de forma benigna, en casos raros puede dar metástasis. El diagnóstico es complejo y puede ser confundido con el tumor estromal gastrointestinal. A continuación, presentamos un caso de una mujer de 43 años con tumor gástrico grande, que fue extirpado quirúrgicamente en su totalidad y cuyo diagnóstico final se basó en sus características clínicas, histopatológicas e inmunohistoquímicas.
Abstract
Inflammatory myofibroblastic tumor is an uncommon neoplasm of the stomach; it is often diagnosed in children and young adults. Although in most cases it behaves benign, in rare cases it can metastasize. The diagnosis is complex, and it can be confused with gastrointestinal stromal tumor. Here we present a case of a 43-year-old woman with a large gastric tumor that was completely removed surgically and whose final diagnosis was based on clinical, histopathologic and immunohistochemical features.
Introducción
El tumor miofibroblástico inflamatorio (TMI) es una neoplasia de potencial biológico intermedio que frecuentemente recurre y raramente puede dar metástasis (1). Es una neoplasia inusual, se caracteriza por proliferación de células mesenquimales miofibroblásticas fusiformes acompañadas de infiltrado inflamatorio de células plasmáticas, linfocitos y eosinófilos. A pesar de que estos tumores ocurren principalmente en el pulmón y partes blandas en niños, en tiempos recientes se han descrito en múltiples vísceras y afectan a un amplio rango de edad (2–8); así pues, se ha detectado el TMI en el tracto gastrointestinal donde dicha afectación es extremadamente rara (4,5,9,10). En el presente trabajo, reportamos el caso de un TMI con apariencia de una lesión polipoide gástrica de 6 cm presente en una mujer adulta, quien, luego de la intervención quirúrgica, pudo ser diagnosticada con base en las características clínicas, histopatológicas e inmunohistoquímicas del tumor.
Caso Clínico
Paciente femenina de 43 años, multigestante, sin historial clínico importante, antecedentes quirúrgicos de apendicectomía, colecistectomía, ligadura de trompas y abdominoplastia, quien consulta por cuadro de sangrado digestivo alto caracterizado por manifestar desde hace tres meses anorexia, molestias abdominales vagas. Desde hace un mes, padece dolor abdominal que se exacerba en la madrugada, melenas y lipotimia, por lo que es hospitalizada para estudio. A su ingreso, afebril, hemodinámicamente estable (PA: 150/90, P: 94, Sat O2: 91%), pálida, bien hidratada, ventila sin problema, en abdomen no hay masas palpables, al tacto rectal se evidenció guante manchado de sangre negruzca.
La endoscopía reportó distensibilidad y movilidad conservada en cuerpo gástrico; por la curvatura mayor hacia cara posterior, se encontró tumoración polipoide de 6 cm de diámetro de aspecto infiltrativo, sólida, bien delimitada, con superficie lisa, con cierta rigidez en la base, que sangra con facilidad, presentó una zona circundante nodular gruesa de la cual se procedió a realizar la biopsia, la cual reportó una lesión adenomatosa tubular benigna; sin embargo, la muestra no fue representativa del tumor.
La tomografía simple y contrastada de abdomen mostró masa sólida bien delimitada, dependiente de la curvatura mayor, midió 7 cm en sentido anteroposterior, 5.2 cm en sentido craneocaudal y 4.5 cm en sentido transversal, que provocaba retracción de la pared gástrica, lo que alteraba su contorno y provocaba pérdida de planos de clivaje con la pared gástrica, pero no se evidenció extensión hacia la cavidad peritoneal.
Con este diagnóstico, la paciente fue sometida a intervención quirúrgica, se realizó inicialmente una gastrectomía subtotal con estudio transoperatorio que reportó “tumor negativo para malignidad, compatible con tumor estromal gastrointestinal”. En vista de que los bordes quirúrgicos estaban cercanos al límite de resección quirúrgica, se decide ampliar la cirugía a una gastrectomía casi total debido a la localización tumoral alta en cuerpo gástrico, curvatura mayor. Cinco días más tarde, la paciente es dada de alta sin complicaciones.
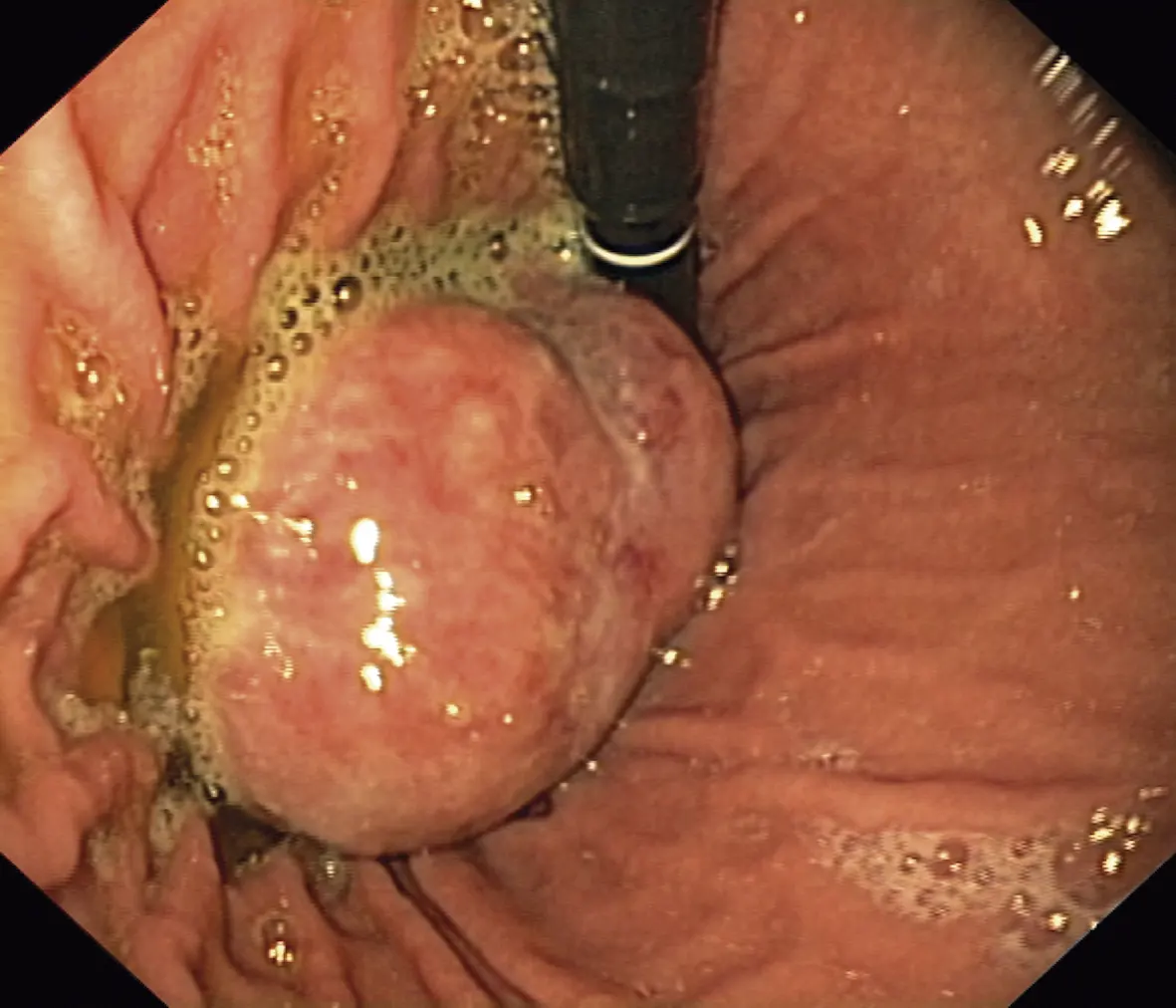
Imagen 1. Durante la EDA se encontró lesión redondeada de 6 cm de diámetro, localizada en la curvatura mayor de cuerpo gástrico alto, hacia cara posterior.
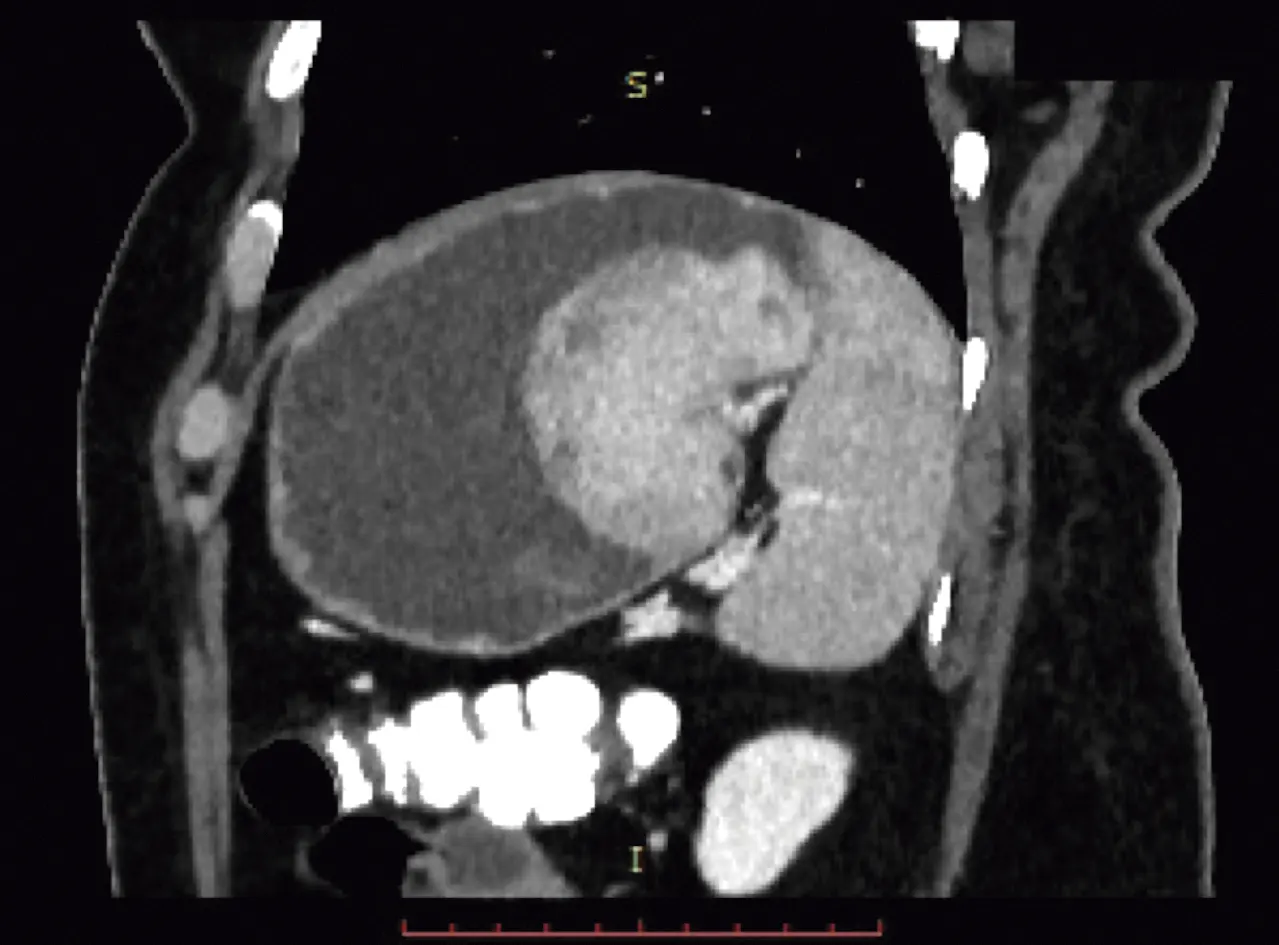
Imagen 2. TAC muestra lesión tumoral sólida lobulada localizada en cuerpo, curvatura mayor, con retracción de la pared gástrica, sin extensión hacia cavidad peritoneal.
En el laboratorio de patología, se recibió para estudio transoperatorio pieza de resección quirúrgica de aspecto polipoide con base ancha, que midió 6 x 5 x 4,5 cm, cubierta por mucosa de color rosado blanquecino, brillante. El tumor estaba a 0.5 cm del límite de resección quirúrgica. Al corte, la consistencia del tumor fue firme, y su superficie interna mostró un tumor sólido con superficie de corte trabecular de color rosado blanquecino. El resultado del transoperatorio fue “compatible con tumor estromal gastrointestinal”.
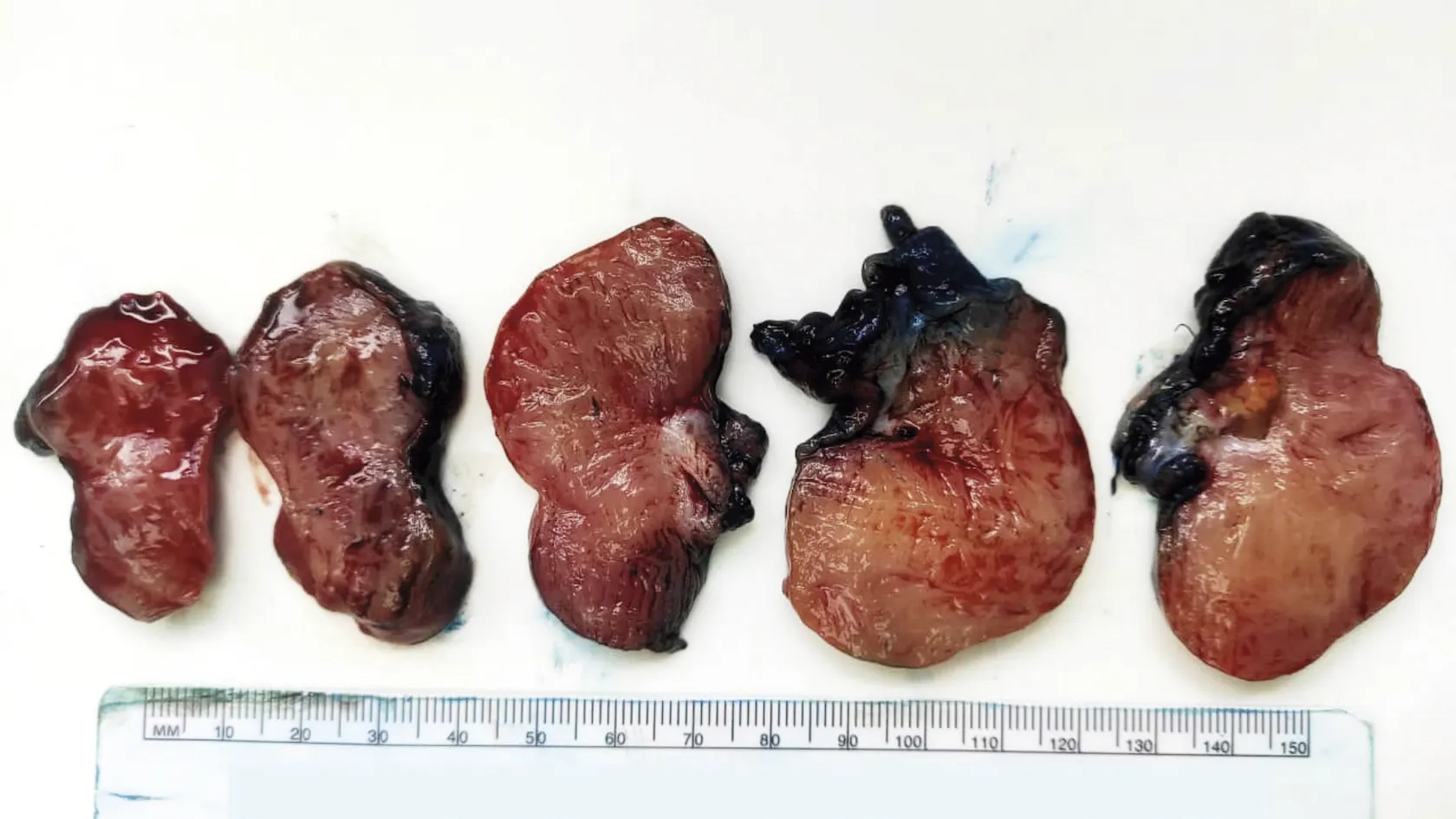
Imagen 3. Imagen macroscópica en la que se observa la superficie interna tumoral, de aspecto trabecular, color café claro brillante muy característica.
Ya en el estudio microscópico del tumor, se pudo observar pared correspondiente a cuerpo gástrico con mucosa de aspecto histológico conservado, y por debajo de ella, se reconoció la presencia de neoplasia mesenquimal caracterizada por la presencia de células de predominio fusiformes, que adoptaban un patrón estoriforme o fascicular, con núcleos vesiculosos, nucléolos prominentes y citoplasma alargado (imagen 5). En otras áreas, las células tumorales presentaron mayor tamaño, con citoplasma amplio, de aspecto epitelioide, algunas con pleomorfismo nuclear moderado y otras multinucleadas (imagen 6 y 7). El estroma mostró edema, ocasionales vasos sanguíneos hemangiopericíticos, e infiltrado inflamatorio linfoplasmocitario prominente, acompañado de histiocitos, unos cuantos PMN y ocasionales eosinófilos. Se encontró actividad mitótica dispersa (10 x 50 CAP). La neoplasia estromal presentó compromiso transmural subepitelial hasta llegar a la subserosa del órgano, con crecimiento tumoral expansivo (no infiltrativo). No se identificó áreas de necrosis tumoral.
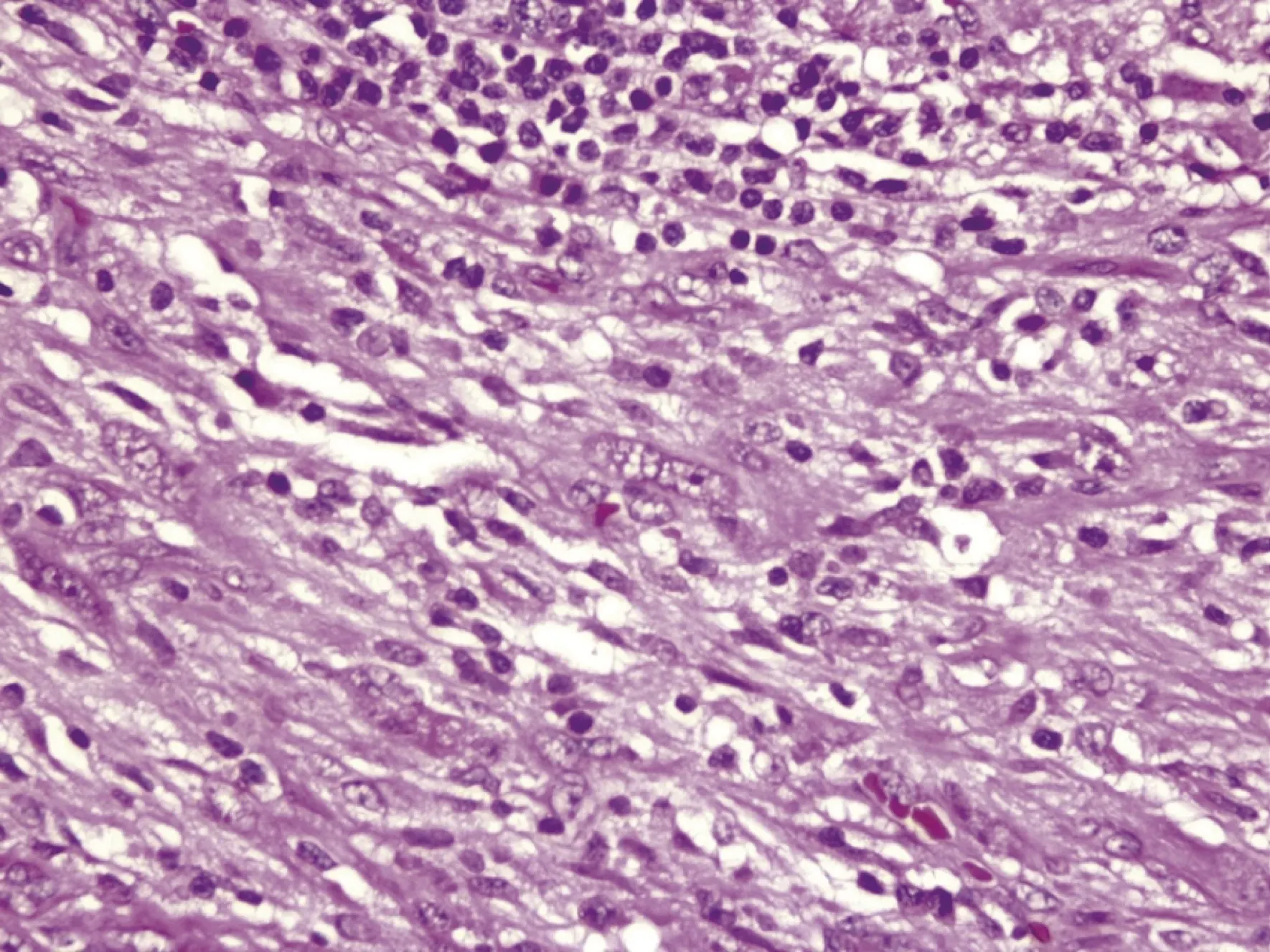
Imagen 4. A nivel microscópico, las células neoplásicas muestran aspecto fusiforme, con núcleos alargados con extremos romos, vesiculosos, con nucléolos prominentes que se acompañan de células inflamatorias constituidas por linfocitos y células plasmáticas.
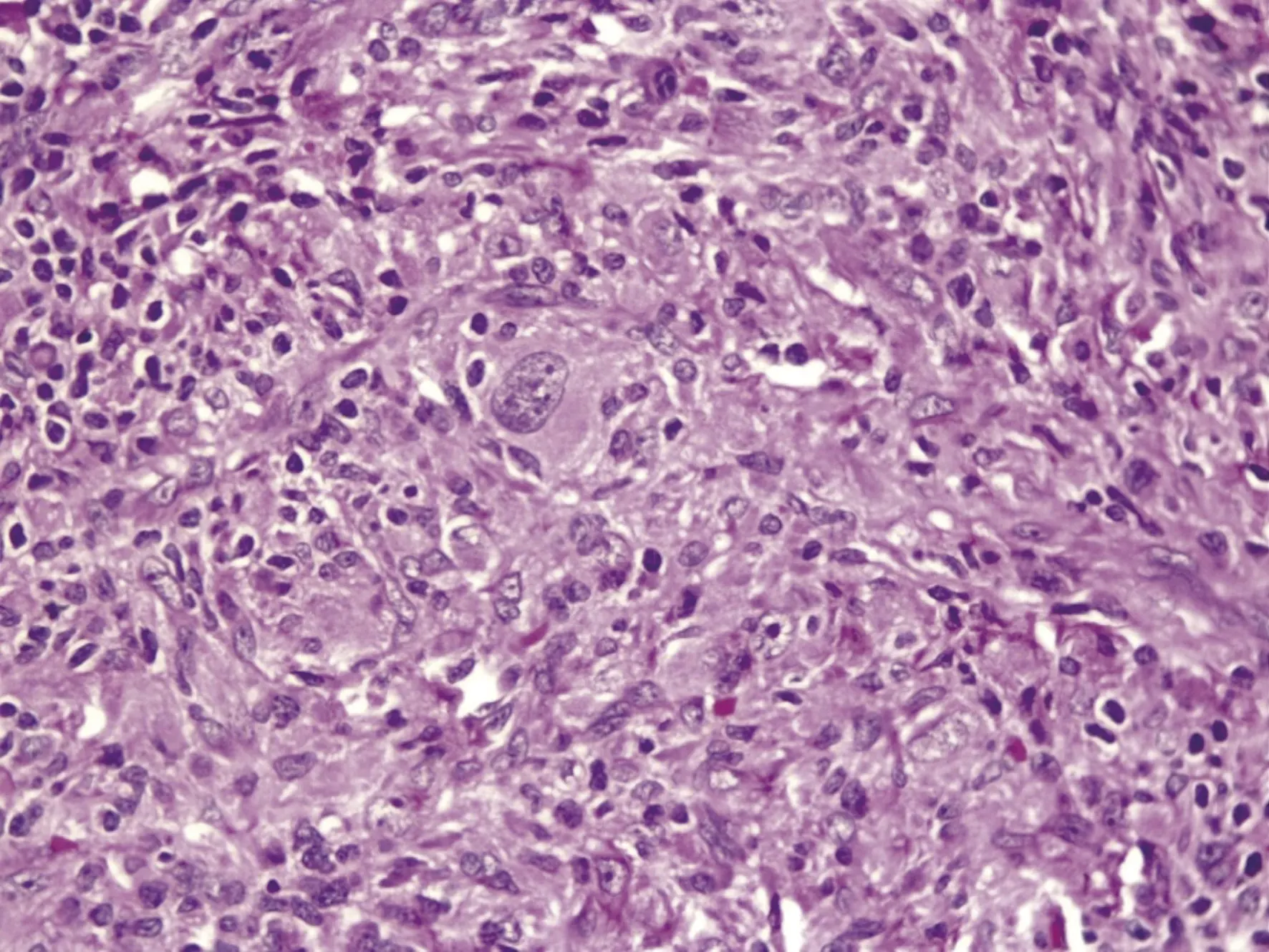
Imagen 5. Se observan ocasionales células atípicas grandes, de núcleos pleomórficos y citoplasma amplio.
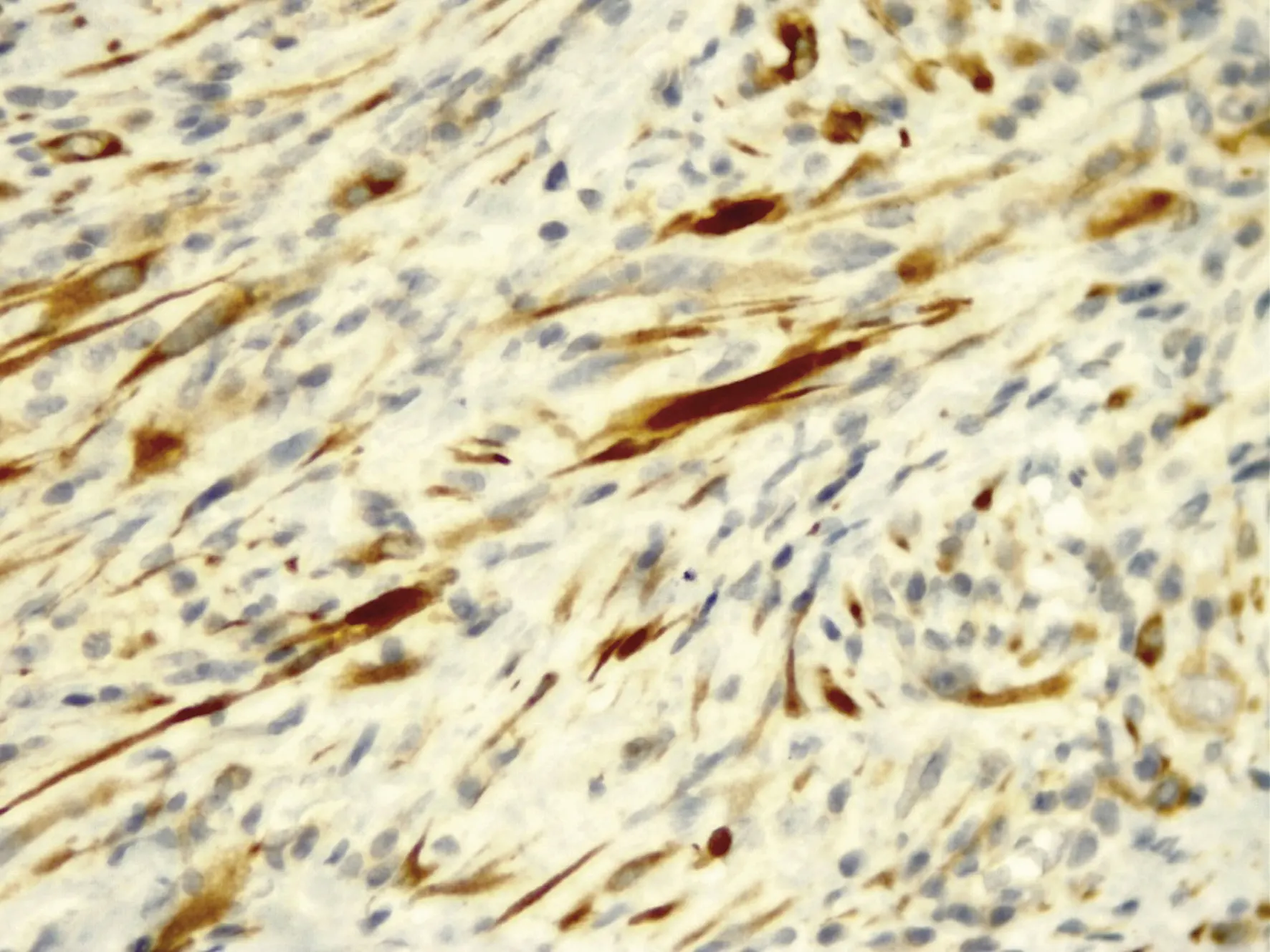
Imagen 6. Tinción de inmunohistoquímica muestra positividad focal para desmina.
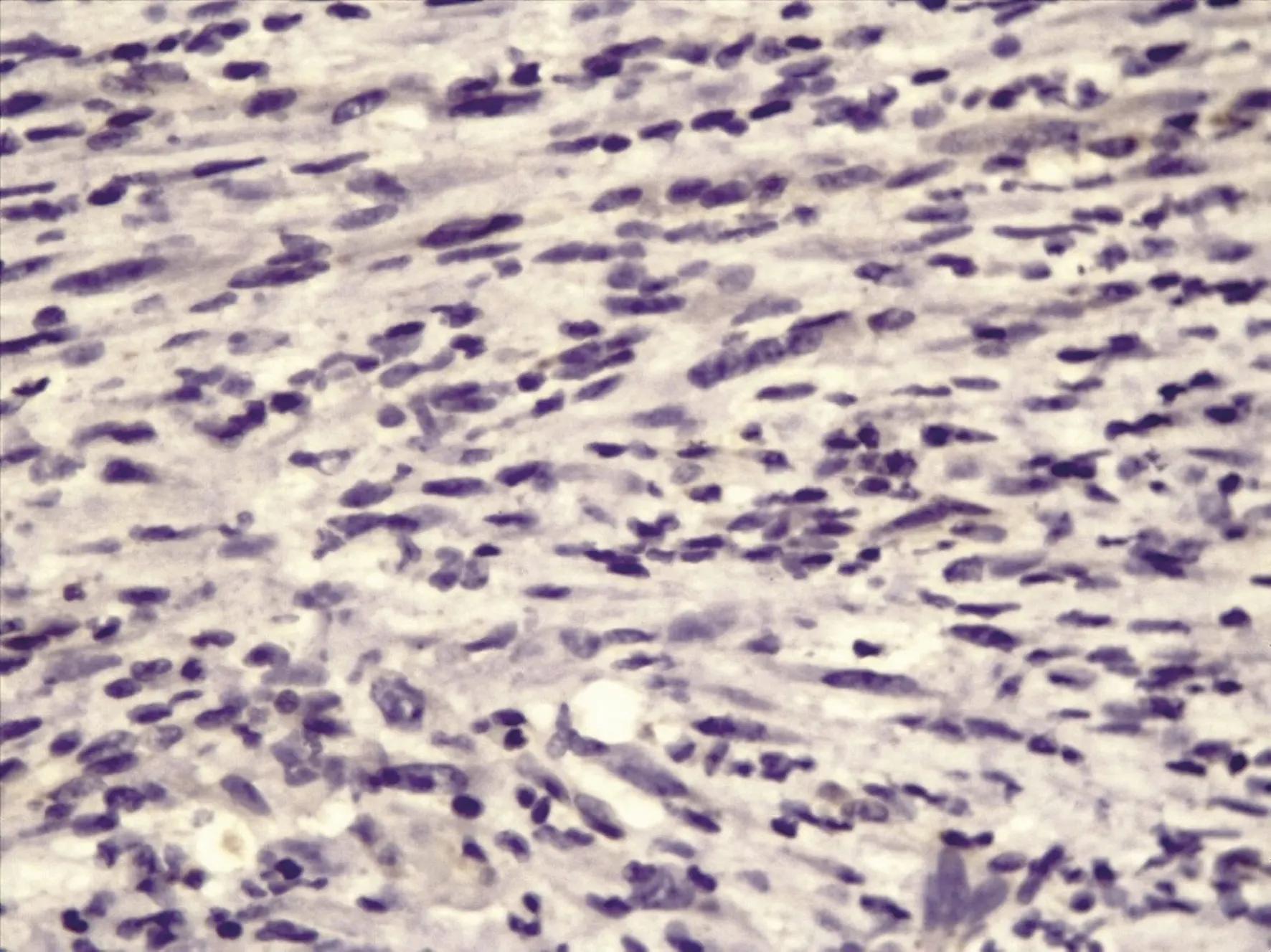
Imagen 7. Tinción de inmunohistoquímica negativa para DOG1.
Las tinciones de inmunohistoquímica mostraron fuerte positividad citoplasmática y nuclear para la vimentina y ciclina D1, respectivamente. Además, positividad focal para la citoqueratina coctel, desmina (imagen 8) y CD10 (CD definido como grupo de diferenciación o subpoblación de antígenos). Las tinciones para DOG1 (imagen 9), CD117, CD34, ALK, AML fueron negativas. Los hallazgos histológicos y de inmunohistoquímica fueron concluyentes con tumor miofibroblástico inflamatorio.
Discusión
El TMI fue descrito inicialmente por Siemens en 1921 (11) y, desde entonces, ha recibido una gran variedad de nombres, tales como fibrosarcoma inflamatorio, pseudotumor inflamatorio o granuloma de células plasmáticas (12–14).
El TMI fue originalmente reportado en el pulmón, pero ha sido reconocido en una variedad de sitios extrapulmonares como, por ejemplo, la piel, órbita, mucosa gingival, glándula mamaria, tiroides, timo, bazo, ganglios linfáticos, lengua, hígado, vesícula biliar, glándula adrenal, útero, ovario, cerebro, médula espinal, mesenterio, apéndice, y en pocas ocasiones ha sido reportado en el tracto gastrointestinal (3–5,8–10,12,13).
El TMF afecta principalmente a niños y adultos jóvenes, pero puede abarcar cualquier rango de edad (1,15,16), como en nuestro caso, que se presentó en una mujer adulta.
La presentación clínica y las características patológicas macroscópicas del tumor miofibroblástico inflamatorio pueden simular una malignidad; sin embargo, estos tumores se comportan de una forma no agresiva (1). Por otra parte, el TMI es considerado un tumor de malignidad intermedia debido a su tendencia para la recurrencia local (25% en tumores abdominopélvicos) y su rareza en dar metástasis (7).
Aunque la forma más común de presentación clínica de TMI es una masa de descubrimiento incidental (o puede estar determinada por el sito de origen y los efectos de masa), una minoría de casos (15-30%) pueden estar asociados con síndrome completo o incompleto de fiebre, pérdida de peso, malestar general, anemia, trombocitosis, hiperglobulinemia y una elevada velocidad de eritrosedimentación (1,15). En el caso actual, nuestra paciente presentó síntomas caracterizados por anorexia, dolor abdominal y sangrado digestivo bajo, producto del efecto de masa causado por el tumor de 6 cm localizado en el cuerpo gástrico.
Durante la última mitad del siglo XX, se debatía sobre si el TMF era un pseudotumor o una neoplasia y si esta era benigna o maligna. Con el descubrimiento de aberraciones citogenéricas en el TMI (14,17,18) y el reconocimiento subsecuente de rearreglos en el gen ALK localizados en el brazo corto del cromosoma como una aberración recurrente en el TMI, el concepto de que el TMI es una neoplasia se fue ratificando.
Actualmente, el TMI es reconocido como una neoplasia específica entre la larga categoría descriptiva de procesos inflamatorios esclerosantes y fibrosos. El gen del ALK codifica un receptor de tirosin kinasa y los rearreglos del gen ALK fueron primeramente documentados en el linfoma anaplásico de células grandes (19).
La alteración ALK generalmente conduce a la sobreexpresión de la proteína ALK y es detectable por inmunohistoquímica, que típicamente demuestra reactividad citoplásmica en el TMI, y también es detectable por citogenética convencional, FISH y reacción en cadena de la polimerasa con transcriptasa inversa (20). La positividad para ALK mediante inmunohistoquímica está presente en 40-100% de los TMI, dependiendo de la localización anatómica (7,19,21,22). En nuestro caso, se realizó análisis de ALK mediante inmunohistoquímica, la cual fue negativa en las células tumorales.
Desde el punto de vista histopatológico, el TMI está compuesto por células miofibroblásticas acompañadas de células plasmáticas, linfocitos y eosinófilos en menor cantidad. Se han descrito tres patrones histológicos básicos en el TMI (1). En primer lugar, un patrón fibromixoide/vascular, que se caracterizaba por una gran separación de células fusiformes entre estrelladas y abultadas en un patrón mixoide, edematoso o delicado estroma fibroso suelto con una red vascular rica más o menos regular y células inflamatorias. En segundo lugar, un patrón estoriforme o fascicular, se caracteriza por proliferación más compacta de células fusiformes dispuestas en un patrón fascicular o estoriforme. Los núcleos son alargados con extremos romos. Las células plasmáticas, algunas con cuerpos de Russell, son el tipo de célula inflamatoria predominante. Y, finalmente, un patrón esclerosante en el que se observa un estroma hipocelular esclerótico hialinizado de moderado a extenso. Una combinación de los tres patrones histológicos puede estar presente. En nuestro caso se identificó dos patrones histológicos, el más extenso fue el patrón estoriforme con prominente infiltrado linfoplasmocitario acompañado de un patrón fibromixoide focal.
La afectación gástrica por el tumor miofibroblástico inflamatorio es extremadamente rara, fue descrita por primera vez en 1970 por Soga y colaboradores (12); aunque ha sido reportado con mayor frecuencia en pacientes pediátricos o adultos jóvenes, afecta a adultos de mayor edad. En nuestro conocimiento, hasta la actualidad existen menos de 30 casos publicados (3–5,8,9,12,13,15,23).
En cuanto a los diagnósticos diferenciales, se encuentran el tumor del estroma gastrointestinal (GIST), el pólipo fibroso inflamatorio (PFI), neoplasias de músculo liso, tumor de la vaina nerviosa periférica, el tumor fibroso solitario (TFS), la fibromatosis y, raramente, el sarcoma de células dendríticas foliculares (24).
El GIST es el tumor mesenquimatoso más común. Macroscópicamente, el GIST puede mostrar formación de quistes, hemorragia o necrosis, y solo ocasionalmente está presente en algunos TMI (25). El GIST suele mostrar proliferación de células fusiformes. Sin embargo, la variante epitelioide también es bien conocida. El GIST no suele tener el fondo inflamatorio. Además, algunas células del GIST tienen vacuolas citoplasmáticas, algo que no se ve en el TMI.
Mediante inmunohistoquímica, el GIST es positivo para la CD117 y DOG1, pero negativo para ALK, mientras que el TMI muestra un perfil opuesto. En nuestro caso, el CD117 y CD 34 fueron completamente negativos en las células tumorales.
Los pólipos fibroides inflamatorios (IFP) son tumores mesenquimales benignos poco frecuentes, de histogénesis poco clara (9). Los IFP suelen ocupar la submucosa; sin embargo, con frecuencia se extienden a la mucosa suprayacente y en ocasiones pueden expandirse transmuralmente. En cuanto a su histología, hay una proliferación de células estromales fusiformes y estrelladas que tienden a condensarse alrededor de los vasos sanguíneos para formar manguitos perivasculares, que están ausentes en los TMI. Tanto el IFP como el TMI tienen un fondo inflamatorio, pero el fondo inflamatorio en el primero es rico en eosinófilos (9). Las células estromales de los IFP son sistemáticamente positivas para CD34, fascina y ciclina D1, pero negativas para ALK (26). En nuestro caso, el predominio de infiltrado linfoplasmocitario y no de eosinófilos, ausencia de manguitos celulares perivascular y negatividad para el CD34 descartaron el IFP.
Los tumores de músculo liso, incluyendo el leiomioma y el leiomiosarcoma, también pueden ocurrir en el estómago (27). Los leiomiomas gástricos se caracterizan por la disposición fascicular de células fusiformes, con o sin un citoplasma eosinófilo prominente. Se originan principalmente en la muscular de la mucosa y pueden ser de tamaño muy pequeño (27). El leiomiosarcoma del estómago es muy raro y muestra una mayor celularidad, de tipo atipia nuclear al menos moderada, y un aumento de la actividad mitótica. Los tumores de músculo liso gástrico no suelen tener un fondo inflamatorio. Inmunohistoquímicamente, los tumores de músculo liso son difusamente positivos para desmina, actina y caldesmón, pero son negativos en el TMI (27). En el presente caso, tanto la presencia de infiltrado inflamatorio como la negatividad para la actina músculo liso descartan este tipo de tumores.
El schwannoma puede imitar ocasionalmente al TMI. A diferencia de los schwannomas de otras partes del cuerpo, los schwannomas gástricos carecen de un empalizamiento nuclear bien definido, cuerpos de Verocay, células de xantoma y paredes vasculares hialinizadas (28). Típicamente, hay un agregado linfoide periférico tipo manguito con o sin centros germinales asociados con el schwannoma gástrico primario (28,29). La tinción para S100 es positiva en todos los schwannomas gástricos, pero en este caso particular es completamente negativa.
El tumor fibroso solitario y la fibromatosis son tumores que afectan a la serosa gástrica o se localizan en el epiplón, el mesenterio, y son extremadamente raros como tumores intramurales como es el caso de los TMI (30). La ausencia de infiltración inflamatoria linfoplasmática prominente, la positividad para CD34 y beta-catenina (fibromatosis) y la negatividad para ALK ayudaron a excluir estos diagnósticos diferenciales. En el presente caso, si bien se pudo observar vasos hemangiopericíticos, la localización tumoral fue submucosa transmural y, mediante inmunohistoquímica, se estableció negatividad para el CD34, descartando así un TFS. La presencia de fibrosis fue mínima en nuestro caso, por lo que morfológicamente se descartó una fibromatosis.
Por último, un tumor muy poco frecuente en el estómago, que puede tener un fondo inflamatorio, es el sarcoma folicular de células dendríticas (24). Un panel inmunohistoquímico que incluya CD21, CD23, CD35 y ALK debería permitir distinguir este tumor del TMI, pero en este caso, la ausencia de atipia celular marcada excluyó esta posibilidad diagnóstica.
Aunque la mayoría de TMI son benignos, requieren resección quirúrgica completa, ya que son propensos a la recurrencia local y a las metástasis en muy raras ocasiones. No obstante, las opciones son limitadas para pacientes en los que el tumor es irresecable y/o la enfermedad es avanzada, aunque existe un reporte de TMI gastrointestinal pequeño que fue tratado a base de antiinflamatorios no esteroidales con resultados satisfactorios (6). En los últimos años se han descubierto genes de fusión en ALK, ROS1 o PDGFRB utilizando secuencia de próxima generación, lo que sugiere que el TMI es en gran medida una neoplasia impulsada por la fusión de quinasas. El estudio se inició por la espectacular respuesta al inhibidor de ROS1 “crizotinib” en un caso anecdótico de un paciente pediátrico con IMT ALK negativo refractario al tratamiento (31). Además, se ha descrito que los TMI tienen una expresión de PD-L1 constitutiva y adaptativa frecuente, la última de las cuales se cree que predice la respuesta a anti-PD-1. Estos datos apoyan una mayor investigación sobre el bloqueo de PD-1 / PD-L1 en este tipo de tumores (32). En nuestro caso, por tratarse de un tumor de gran tamaño, localizado en la parte alta de cuerpo gástrico curvatura mayor, se prefirió la extirpación quirúrgica completa mediante gastrectomía total.
En resumen, presentamos un caso muy raro, poco descrito en la literatura, haciendo hincapié en sus características clínico-patológicas, diagnósticos diferenciales y la importancia de un completo abordaje multidisciplinario para un correcto diagnóstico y tratamiento. Luego del procedimiento quirúrgico, la paciente tuvo una recuperación satisfactoria y luego de seis meses de seguimiento, hasta la fecha de esta publicación no ha presentado recurrencia tumoral.
Conclusiones
- El TMI es un tumor infrecuente en el tracto gastrointestinal, y su localización gástrica es extremadamente rara.
- Se caracteriza por proliferación de células miofibroblásticas fusiformes acompañadas de infiltrado inflamatorio linfoplasmocitario.
- El principal diagnóstico diferencial es el tumor estromal gastrointestinal (GIST).
- La inmunohistoquímica es de gran importancia para establecer el diagnóstico correcto.
Referencias
- Coffin CM, Watterson J, Priest JR, Dehner LP. Extrapulmonary inflammatory myofibroblastic tumor (inflammatory pseudotumor): A clinicopathologic and immunohistochemical study of 84 cases. Am J Surg Pathol [Internet]. 1995 [cited 2021 Apr 29];19(8):859–72. Available from: https://pubmed.ncbi.nlm.nih.gov/7611533/
- Wang S, Chen L, Cao Z, Mao X, Zhang L, Wang B. Inflammatory myofibroblastic tumor of the lumbar spinal canal: A Case Report with Literature Review. Med (United States) [Internet]. 2017 Jun 1 [cited 2021 May 28];96(26). Available from: https://pubmed.ncbi.nlm.nih.gov/28658093/
- Cheng B, Yang C, Liu Z, Liu L, Zhou L. Primary gastric inflammatory myofibroblastic tumor A case report. Med (United States). 2018 Dec 1;97(50).
- Hayashi M, Kawakubo H, Mayanagi S, Nakamura R, Suda K, Wada N, et al. Gastric inflammatory myofibroblastic tumor treated with combined laparoscopic and endoscopic gastric wedge resection: A case report. World J Surg Oncol. 2018 Aug 8;16(1).
- Riedel BD, Wong RC, Ey EH. Gastric inflammatory myofibroblastic tumor (inflammatory pseudotumor) in infancy: Case report and review of the literature. J Pediatr Gastroenterol Nutr [Internet]. 1994 [cited 2021 Apr 29];19(4):437–43. Available from: https://pubmed.ncbi.nlm.nih.gov/7877000/
- Park SG, Kim GH, Park HJ, Kahng DH, Lee BE, Park DY. Case of an Inflammatory Myofibroblastic Tumor of the Duodenum. Korean J Gastroenterol [Internet]. 2018 Jul 25 [cited 2021 May 24];72(1):28–32. Available from: https://pubmed.ncbi.nlm.nih.gov/30049175/
- Coffin CM, Hornick JL, Fletcher CDM. Inflammatory myofibroblastic tumor: Comparison of clinicopathologic, histologic, and immunohistochemical features including ALK expression in atypical and aggressive cases. Am J Surg Pathol [Internet]. 2007 Apr [cited 2021 Apr 29];31(4):509–20. Available from: https://pubmed.ncbi.nlm.nih.gov/17414097/
- Kim GH, Park DY. A Rare Cause of Gastric Subepithelial Tumor. Clin Endosc [Internet]. 2020 May [cited 2021 Apr 29];53(3):377–8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/32506895
- Makhlouf HR, Sobin LH. Inflammatory myofibroblastic tumors (inflammatory pseudotumors) of the gastrointestinal tract: How closely are they related to inflammatory fibroid polyps? Hum Pathol [Internet]. 2002 [cited 2021 Apr 29];33(3):307–15. Available from: https://pubmed.ncbi.nlm.nih.gov/11979371/
- Primary gastric inflammatory myofibroblastic tumor: a clinicopathologic and immunohistochemical study of 5 cases – PubMed [Internet]. [cited 2021 Apr 29]. Available from: https://pubmed.ncbi.nlm.nih.gov/20304564/
- D: S. Primary hemangiolymphoma of the hemal nodes: An unusual variety of malignant tumors. Arch Int Med. 1921;38:467–74.
- Soga J, Saito K, Suzuki N, Sakai T. Plasma cell granuloma of the stomach. A report of a case and review of the literature. Cancer [Internet]. 1970 [cited 2021 Apr 30];25(3):618–25. Available from: https://pubmed.ncbi.nlm.nih.gov/5416828/
- Tada T, Wakabayashi T, Kishimoto H. Plasma cell granuloma of the stomach. A report of a case associated with gastric cancer. Cancer [Internet]. 1984 [cited 2021 Apr 30];54(3):541–4. Available from: https://pubmed.ncbi.nlm.nih.gov/6375856/
- Treissman SP, Gillis DA, Lee CL et al. Omental-mesenteric inflammatory pseudotumor. Cytogenetic demonstration of genetic changes and monoclonality in one tumor. Cancer. 1994;(73):1433–7.
- Souid AK, Ziemba MC, Stephen Dubansky A, Mazur M, Oliphant M, Deaver Thomas F, et al. Inflammatory myofibroblastic tumor in children. Cancer [Internet]. 1993 [cited 2021 May 21];72(6):2042–8. Available from: https://pubmed.ncbi.nlm.nih.gov/8364883/
- RAMACHANDRA S, HOLLOWOOD K, BISCEGLIA M, FLETCHER CDM. Inflammatory pseudotumour of soft tissues: a clinicopathological and immunohistochemical analysis of 18 cases. Histopathology [Internet]. 1995 [cited 2021 May 21];27(4):313–23. Available from: https://pubmed.ncbi.nlm.nih.gov/8847061/
- Su LD, Atayde-Perez A, Sheldon S et al. Inflammatory myofibroblastic tumor: cytogenetic evidence supporting clonal origin. Mod Pathol. 1998;11:364–8.
- Snyder CS, Dell’Aquila M, Haghighi P et al. Clonal changes in inflammatory pseudotumor of the lung: a case report. Cancer. 1995;(76):1545–9.
- Cook JR, Dehner LP, Collins MH, Ma Z, Morris SW, Coffin CM, et al. Anaplastic lymphoma kinase (ALK) expression in the inflammatory myofibroblastic tumor: A comparative immunohistochemical study. Am J Surg Pathol [Internet]. 2001 [cited 2021 Apr 29];25(11):1364–71. Available from: https://pubmed.ncbi.nlm.nih.gov/11684952/
- Cessna MH, Zhou H, Sanger WG, Perkins SL, Tripp S, Pickering D, et al. Expression of ALK1 and p80 in inflammatory myofibroblastic tumor and its mesenchymal mimics: A study of 135 cases. Mod Pathol [Internet]. 2002 [cited 2021 May 24];15(9):931–8. Available from: https://pubmed.ncbi.nlm.nih.gov/12218210/
- Rabban JT, Zaloudek CJ, Shekitka KM, Tavassoli FA. Inflammatory myofibroblastic tumor of the uterus: A clinicopathologic study of 6 cases emphasizing distinction from aggressive mesenchymal tumors. Am J Surg Pathol [Internet]. 2005 Oct [cited 2021 May 24];29(10):1348–55. Available from: https://pubmed.ncbi.nlm.nih.gov/16160478/
- Montgomery EA, Shuster DD, Burkart AL, Esteban JM, Sgrignoli A, Elwood L, et al. Inflammatory myofibroblastic tumors of the urinary tract: A clinicopathologic study of 46 cases, including a malignant example inflammatory fibrosarcoma and a subset associated with high-grade urothelial carcinoma. Am J Surg Pathol [Internet]. 2006 Dec [cited 2021 May 24];30(12):1502–12. Available from: https://pubmed.ncbi.nlm.nih.gov/17122505/
- Shi H, Wei L, Sun L, Guo A. Primary gastric inflammatory myofibroblastic tumor: A clinicopathologic and immunohistochemical study of 5 cases. Pathol Res Pract [Internet]. 2010 May [cited 2021 May 28];206(5):287–91. Available from: https://pubmed.ncbi.nlm.nih.gov/20304564/
- Han JH, Kim SH, Noh SH, Lee YC, Kim HG, Yang WI. Follicular dendritic cell sarcoma presenting as a submucosal tumor of the stomach. Arch Pathol Lab Med [Internet]. 2000 [cited 2021 May 27];124(11):1693–6. Available from: https://pubmed.ncbi.nlm.nih.gov/11079028/
- Charville GW, Longacre TA. Surgical Pathology of Gastrointestinal Stromal Tumors: Practical Implications of Morphologic and Molecular Heterogeneity for Precision Medicine [Internet]. Vol. 24, Advances in Anatomic Pathology. Lippincott Williams and Wilkins; 2017 [cited 2021 May 27]. p. 336–53. Available from: https://pubmed.ncbi.nlm.nih.gov/28820749/
- Pantanowitz L, Antonioli DA, Pinkus GS, Shahsafaei A, Odze RD. Inflammatory Fibroid Polyps of the Gastrointestinal Tract: Evidence for a Dendritic Cell Origin [Internet]. Vol. 28, American Journal of Surgical Pathology. Am J Surg Pathol; 2004 [cited 2021 May 27]. p. 107–14. Available from: https://pubmed.ncbi.nlm.nih.gov/14707872/
- Agaimy A, Wünsch PH. True smooth muscle neoplasms of the gastrointestinal tract: Morphological spectrum and classification in a series of 85 cases from a single institute. Langenbeck’s Arch Surg [Internet]. 2007 Jan [cited 2021 May 27];392(1):75–81. Available from: https://pubmed.ncbi.nlm.nih.gov/17021790/
- Sánchez-Morales GE, Trolle-Silva AM, Moctezuma-Velázquez P, Rodríguez-Quintero JH, Alcazar-Félix RJ. Gastric schwannoma: A rarity among mesenchymal tumors of the gastrointestinal tract. Rev Gastroenterol Mex [Internet]. 2020 Jan 1 [cited 2021 May 27];85(1):102–4. Available from: https://pubmed.ncbi.nlm.nih.gov/31427112/
- Hou YY, Tan YS, Xu JF, Wang XN, Lu SH, Ji Y, et al. Schwannoma of the gastrointestinal tract: A clinicopathological, immunohistochemical and ultrastructural study of 33 cases. Histopathology [Internet]. 2006 Apr [cited 2021 May 27];48(5):536–45. Available from: https://pubmed.ncbi.nlm.nih.gov/16623779/
- Lee WA, Lee MK, Jeen YM, Kle JH, Chung JJ, Yun SH. Solitary fibrous tumor arising in gastric serosa. Pathol Int [Internet]. 2004 Jun [cited 2021 May 27];54(6):436–9. Available from: https://pubmed.ncbi.nlm.nih.gov/15144403/
- Lovly CM, Gupta A, Lipson D, Otto G, Brennan T, Chung CT, et al. Inflammatory myofibroblastic tumors harbor multiple potentially actionable Kinase fusions. Cancer Discov [Internet]. 2014 [cited 2021 May 30];4(8):889–95. Available from: https://pubmed.ncbi.nlm.nih.gov/24875859/
- Cottrell TR, Duong AT, Gocke CD, Xu H, Ogurtsova A, Taube JM, et al. PD-L1 expression in inflammatory myofibroblastic tumors. Mod Pathol [Internet]. 2018 Jul 1 [cited 2021 May 30];31(7):1155–63. Available from: https://pubmed.ncbi.nlm.nih.gov/29449680/
Como citar el presente artículo:
Ortega-Espinosa P. Tumor miofibroblástico inflamatorio gástrico, reporte de caso con énfasis en sus características clínico-patológicas. Reporte de caso. Indexia. Diciembre 2024.
Todos los artículos se publican bajo la licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0), lo que permite compartir y adaptar el contenido siempre que se dé el crédito adecuado a los autores y a la revista.
