REVISIÓN BIBLIOGRÁFICA
Niveles de anticuerpos IgG en adultos tras la vacunación anti-COVID-19: una revisión bibliográfica
IgG Antibody Levels in Adults After Anti-COVID-19 Vaccination: a bibliographic Review
Verónica Santiago-Villarreal 1 A; Anthony Villalba-Lozano 1 B:
- Facultad de Ciencias de la Salud. Universidad Técnica Particular de Loja. Ecuador
Palabras Clave: COVID-19, Inmunoglobulina G, vacunación
Keywords: Covid-19, Immunoglobulin G, Vaccination
Fecha recepción: 30-05-2025
Fecha aceptación: 17-07-2025
Fecha publicación: 23-07-2025
DOI: 10.65183/revind.e14.05
Resumen
El SARS-CoV-2, un patógeno de alta transmisibilidad, ha desencadenado una pandemia global con un costo significativo en morbilidad y mortalidad. Como respuesta preventiva crucial, se ha acelerado el desarrollo de vacunas. No obstante, se han evidenciado fluctuaciones en la respuesta inmunitaria y la duración de los anticuerpos entre individuos vacunados, lo que ha impulsado la necesidad de esquemas de vacunación optimizados, incluyendo la administración de múltiples dosis y combinaciones homólogas y heterólogas, para asegurar la persistencia de anticuerpos protectores. El presente estudio se propuso investigar los niveles de anticuerpos IgG alcanzados en adultos tras la vacunación contra el COVID-19 mediante una revisión de la literatura biomédica. Se realizó una búsqueda en bases de datos como PubMed, Web of Science y BVS utilizando descriptores MeSH y DeCS. Tras el análisis de 116 estudios, los resultados indicaron que la combinación heteróloga de una dosis de Pfizer seguida de una de Moderna fue la más eficaz en la inducción de anticuerpos IgG. Se destacó que la respuesta inmunitaria varía significativamente en poblaciones de edad avanzada, donde los niveles de anticuerpos pueden no alcanzar la protección óptima. Sin embargo, se observó que las dosis de refuerzo, especialmente la tercera dosis de Pfizer/BioNTech, fueron altamente efectivas para aumentar tanto los niveles de anticuerpos como su tiempo de prevalencia. Esto sugiere que los esquemas heterólogos, complementados con dosis de refuerzo, son particularmente eficientes en la generación y el mantenimiento de una respuesta inmune amplia.
Abstract
The highly transmissible SARS-CoV-2 pathogen has triggered a global pandemic, incurring significant morbidity and mortality. In response, vaccine development has been crucially accelerated as a preventive measure. However, fluctuations in immune response and antibody duration among vaccinated individuals have become evident, driving the need for optimized vaccination schedules, including the administration of multiple doses and both homologous and heterologous combinations, to ensure the persistence of protective antibodies.This study aimed to investigate the levels of IgG antibodies achieved in adults after COVID-19 vaccination through a comprehensive review of biomedical literature. A systematic search was conducted in databases such as PubMed, Web of Science, and BVS, utilizing MeSH and DeCS descriptors. After analyzing 116 studies, the results indicated that a heterologous combination of one Pfizer dose followed by one Moderna dose was the most effective in inducing IgG antibodies.It was highlighted that the immune response varies significantly in elderly populations, where antibody levels may not reach optimal protection. Nevertheless, it was observed that booster doses, specifically the third dose of Pfizer/BioNTech, were highly effective in increasing both antibody levels and their prevalence duration. This suggests that heterologous regimens, supplemented with booster doses, are particularly efficient in generating and maintaining a broad immune response.
Introducción
A finales de 2019, la detección de múltiples casos de neumonía aguda en Wuhan, China, alertó sobre una posible enfermedad infecciosa. La secuenciación del genoma de un nuevo coronavirus confirmó la identidad del agente causal, posteriormente denominado síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2), y la enfermedad que provoca: COVID-191.
El SARS-CoV-2 es un virus emergente que ha generado una pandemia global debido a su eficiente mecanismo de transmisión2. Su rápida propagación a nivel mundial se vio facilitada por la transmisión aérea y de persona a persona e incluso durante el período de incubación cuando los individuos infectados son asintomáticos. Se estima que esta alta tasa de transmisión, sumada a la globalización, permitió la difusión del virus en un lapso muy breve3.
Este nuevo virus constituyó un grave problema de salud pública. Al 1 de enero de 2023, se habían confirmado 656,050,477 casos y 6,688,095 muertes por COVID-19 a nivel mundial. En Ecuador, se reportaron 3,506 casos confirmados y 23 muertes. Particularmente, en la ciudad de Loja, se registraron 206 casos notificados4.
Ante esta problemática, se han impulsado numerosas investigaciones para desarrollar estrategias de prevención y tratamiento. Si bien aún no se ha encontrado un tratamiento específico, se ha logrado minimizar las complicaciones y reducir los contagios mediante el uso de barreras de protección física y la implementación de vacunas como terapia de apoyo.
La Organización Mundial de la Salud (OMS) ha reportado diversos inmunógenos en ensayos clínicos de fase 3, que incluyen vacunas de ARNm (Moderna, Pfizer), vacunas de virus inactivado (AstraZeneca, Janssen, CanSino, Sinovac), y otras cuyas pruebas fueron suspendidas debido a efectos secundarios en algunos pacientes1.
La vacunación induce el desarrollo de anticuerpos en niveles variables. Inicialmente, se estimaba que los anticuerpos contra el SARS-CoV-2 subsistían al menos 12 meses. Sin embargo, estudios prospectivos a largo plazo han demostrado que la IgG anti-Spike (S) del dominio de unión al receptor persiste en el 96.8% de los pacientes hasta 14 meses después de la vacunación. En general, la literatura científica revela una considerable heterogeneidad en las respuestas inmunitarias entre individuos5.
Considerando lo anteriormente expuesto, la presente revisión bibliográfica tiene como objetivo principal analizar la literatura biomédica disponible sobre los niveles de anticuerpos IgG alcanzados en adultos después de la vacunación contra la COVID-19 a nivel mundial. Concretamente, se indagará en la influencia de las diferentes composiciones químicas de las vacunas, el número de dosis administradas y las estrategias de combinación de vacunas (esquemas heterólogos) en la respuesta inmunitaria humoral.
Metodología
Esta revisión bibliográfica se llevó a cabo mediante la búsqueda de información de la literatura científica enfocada en los niveles de anticuerpos IgG en adultos después de la vacunación anti-COVID-19. La estrategia de búsqueda se fundamentó en la pregunta PICO (ver tabla 1).
Tabla 1
Estrategia PICO: En adultos (P) vacunados, ¿cuáles son los niveles de los anticuerpos IgG (O) después de la vacunación contra el COVID-19 (I), en comparación con diferentes tipos de vacunas y esquemas de dosificación (C)?

Se identificaron descriptores clave tanto en español (DeCS) como en inglés (MeSH) para construir ecuaciones de búsqueda específicas. Dichas ecuaciones se adaptaron a las siguientes bases de datos electrónicas: PubMed, Web of Science y Biblioteca Virtual en Salud (BVS).
Se incluyeron algunos tipos de artículos: originales, observacionales o experimentales y ensayos clínicos. Los estudios debían haber sido publicados en los últimos cinco años, estar disponibles en idioma inglés o español y, además, presentar datos completos que abordaran el tema de esta revisión. Se excluyeron manualmente tesis, revisiones narrativas, artículos duplicados entre las bases de datos y textos incompletos.
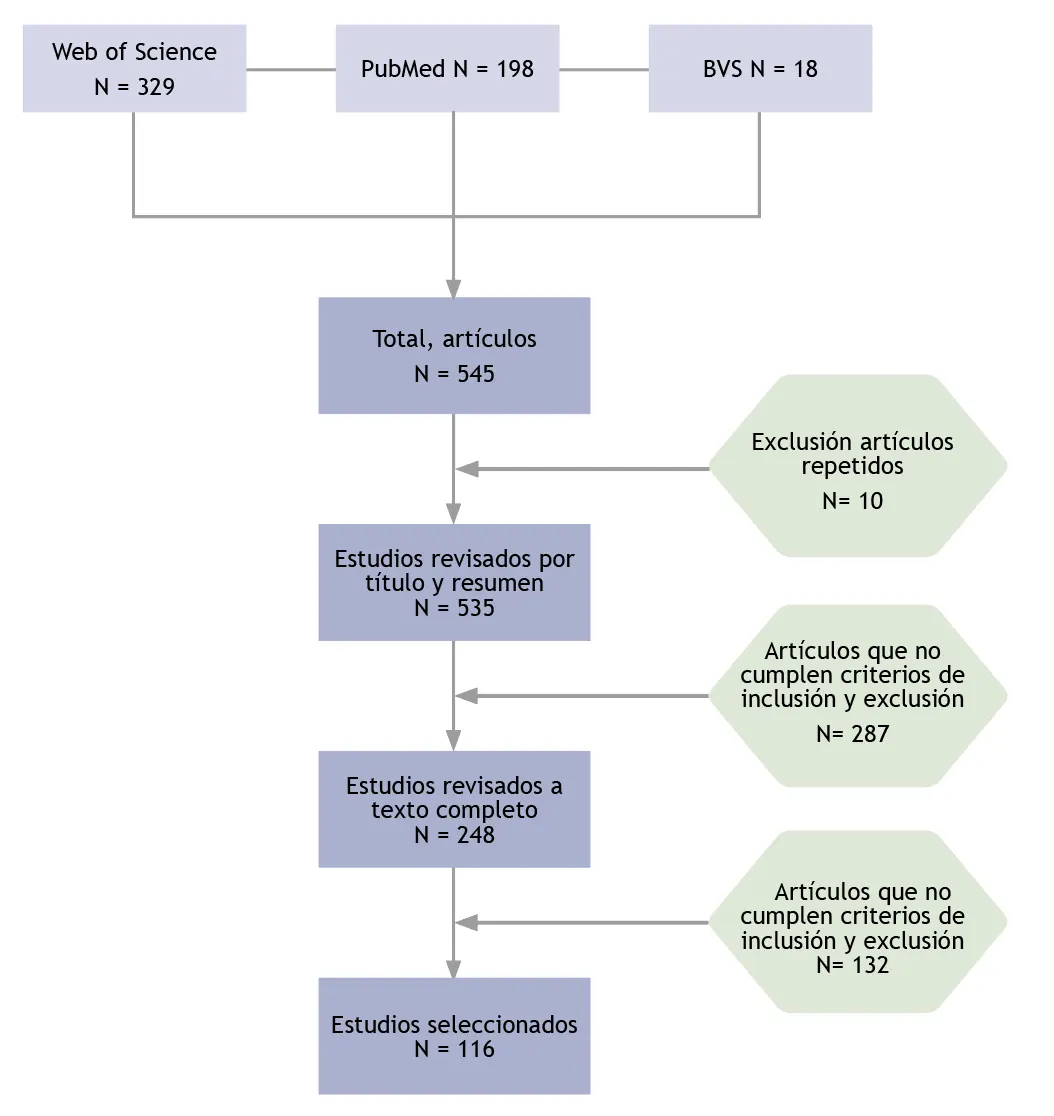
Los descriptores se combinaron utilizando los operadores booleanos «AND» y «OR» en las diferentes bases de datos, y se optimizaron las ecuaciones de búsqueda para maximizar la recuperación de estudios pertinentes. La aplicación de estos descriptores arrojó un total de 545 artículos relacionados con COVID-19, inmunoglobulina G, vacunación, población adulta y personal de salud.
Posteriormente, se realizó una revisión inicial por título y resumen de estos 545 artículos. En esta etapa, se excluyeron 10 artículos duplicados y 287 que no cumplían con los criterios de inclusión preestablecidos. Los 248 artículos restantes fueron sometidos a una revisión a texto completo. De estos, 132 artículos no cumplieron con los criterios de inclusión y exclusión, lo cual llevó a una selección final de 116 estudios para la extracción de datos (ver figura 1).
Figura 1. Diagrama de flujo
Resultados
De los 545 artículos inicialmente identificados, se aplicaron los criterios de inclusión y exclusión y resultó en la selección de 116 estudios para esta investigación. Los hallazgos de estos estudios revelaron varios patrones consistentes y algunas diferencias importantes en la respuesta inmunológica debido a las diferentes composiciones químicas de las vacunas anti-COVID-19, así como a factores individuales como el grupo poblacional al que pertenece una persona y la exposición previa al SARS-CoV-2.
1. Inmunogenicidad de las vacunas de ARNm (BNT162b2 – Pfizer-BioNTech):
Seroconversión y títulos de anticuerpos elevados: Múltiples estudios (Moghnieh et al., 2021; Shachor-Meyouhas et al., 2021; Müller et al., 2021; Stankov et al., 2021; Malipiero et al., 2021; Khoury et al., 2021; Grupel et al., 2021; Vietri et al., 2021; Mastroianni et al., 2022; Yigit et al., 2022; Padoan et al., 2022; Salvagno et al., 2022; Hibino et al., 2021; Kitabatake et al., 2022; Kim et al., 2021) confirmaron que la vacuna BNT162b2 induce una seroconversión casi universal y niveles elevados de anticuerpos IgG anti-S y anti-RBD después de dos dosis. Por ejemplo, Moghnieh et al. (2021) reportaron GMT de anti-S-IgG de 22,536 BAU/mL después de la segunda dosis, mientras que Grupel et al. (2021) observaron un pico mediano de IgG de 23,801 AU/mL en menores de 50 años.
Declive de anticuerpos con el tiempo: Los estudios (Van Praet et al., 2021; Vietri et al., 2021; Mastroianni et al., 2022; Padoan et al., 2022; Kitabatake et al., 2022) demostraron un declive gradual pero significativo en los niveles de anticuerpos IgG anti-SARS-CoV-2 a lo largo del tiempo, generalmente a partir de los 3 meses luego de la segunda dosis. Vietri et al. (2021) reportaron una disminución de 1901.8 BAU/ml a los 30 días a 1032.4 BAU/ml a los 90 días. Padoan et al. (2022) incluso sugirieron una disminución de aproximadamente el 90% a los 6 meses.
Dosis de refuerzo: La administración de una dosis de refuerzo de BNT162b2, ya sea homóloga o heteróloga (después de CoronaVac o ChAdOx1 nCoV-19), se asoció con un aumento de los títulos de anticuerpos según los estudios de Moghnieh et al., 2021; Yigit et al., 2022; Salvagno et al., 2022; Choi et al., 2023. Salvagno et al. (2022) observaron un aumento de casi 40 veces en los niveles de anticuerpos IgG anti-SARS-CoV-2 tras la dosis de refuerzo.
Comparación con infección natural: Hagin et al. (2021) sugirieron que la vacunación con Pfizer-BioNTech resultó en niveles más altos de anticuerpos IgG en comparación con la infección natural en algunos contextos.
Efecto de la edad: Müller et al. (2021) y Grupel et al. (2021) destacaron que las personas mayores (especialmente >80 años) exhiben una respuesta de anticuerpos inicial menor y un declive más rápido en comparación con la gente joven.
2. Inmunogenicidad de vacunas de virus inactivados (CoronaVac-Sinovac, KCONVAC-Shenzhen Kangtai)
Respuesta inmune satisfactoria: Los siguientes estudios: Soysal et al., 2021; Yigit et al., 2022 y Liu et al., 2021 demostraron que estas vacunas indujeron una respuesta inmune humoral medible. Soysal et al. (2021) mostraron niveles significativamente más altos de anticuerpos IgG contra la proteína RBD en trabajadores de la salud previamente infectados (mediana de 1220 AU/mL) en comparación con los no infectados (mediana de 913 AU/mL) después de CoronaVac.
Comparación con vacunas de ARNm: De acuerdo a Yigit et al. (2022), si bien CoronaVac induce una respuesta, los niveles de anticuerpos IgG anti-SARS-CoV-2 fueron progresivamente más altos con la vacuna BNT162b2 mRNA, especialmente después de una dosis de refuerzo.
3. Inmunogenicidad de vacunas de vector viral (Sputnik V-Gamaleya, ChAdOx1 nCoV-19-AstraZeneca, AZD1222-AstraZeneca, MVC-COV1901-Medigen)
Variabilidad en los niveles de anticuerpos: Los estudios sobre Sputnik V (Cordova et al., 2021) y ChAdOx1 nCoV-19/AZD1222 (Torales et al., 2023; Choi et al., 2023; Kim et al., 2021) mostraron que estas vacunas inducen una respuesta de anticuerpos, pero con cierta variabilidad. Cordova et al. (2021) notaron que los niveles de anticuerpos IgG específicos después de Sputnik V variaron con niveles más bajos observados en participantes sin infección previa y más de 14 semanas posvacunación.
Comparación entre vectores virales: Torales et al. (2023) sostienen que la vacuna MVC-COV1901 indujo niveles significativamente más altos de anticuerpos IgG y neutralizantes que AZD1222.
Esquemas heterólogos: Choi et al. (2023) compararon regímenes homólogos (BNT162b2/BNT162b2/BNT162b2) y heterólogos (ChAdOx1 nCoV-19/ChAdOx1 nCoV-19/BNT162b2), encontrando que, aunque el grupo BBB (solo BNT162b2) tuvo niveles más altos de anticuerpos neutralizantes, ambos grupos alcanzaron niveles similares de IgG específica del pico después de la dosis de refuerzo.
4. Factores que influyen en la respuesta inmune
Infección previa: Soysal et al., 2021; Moghnieh et al., 2021 y Khoury et al., 2021 evidenciaron que la infección previa por SARS-CoV-2 se asoció con una respuesta inmune de anticuerpos magnificada y más rápida tras la vacunación.
Cohortes específicas
Trabajadores de la salud: Fueron una población de estudio frecuente en las investigaciones de Shachor-Meyouhas et al., 2021; Van Praet et al., 2021; Malipiero et al., 2021; Soysal et al., 2021; Khoury et al., 2021; Grupel et al., 2021; Vietri et al., 2021; Cordova et al., 2021; Mastroianni et al., 2022; Baj et al., 2022; Padoan et al., 2022; Salvagno et al., 2022; Hibino et al., 2021; Choi et al., 2023; Kitabatake et al., 2022 y Kim et al., 2021, en donde demostraron respuestas inmunes altas, aunque existió variabilidad asociada a la edad y a la exposición de la infección previamente.
Residentes de hogares de ancianos: Van Praet et al. (2021) mostraron que los residentes de hogares de ancianos, especialmente sin infección previa, tenían niveles de anticuerpos significativamente más bajos y un declive más pronunciado que los trabajadores de la salud.
Inmunosuprimidos: Hagin et al. (2021) y Malipiero et al. (2021) exploraron la respuesta en pacientes con errores innatos de inmunidad y enfermedades autoinmunes, señalando la necesidad de optimizar las estrategias de vacunación en estas poblaciones.
Discusión
La presente investigación aborda un aspecto crucial de la salud pública contemporánea: la respuesta de anticuerpos IgG tras la vacunación contra el COVID-19 en la población adulta. La pandemia de COVID-19 ha ejercido una presión sin precedentes en los sistemas de salud globales y ha alterado profundamente la vida cotidiana. En este contexto, la comunidad científica ha respondido con una producción prolífica de literatura, lo cual ha generado datos esenciales para comprender la inmunidad inducida por la vacuna y guiar las estrategias de las entidades
pertinentes. El estudio actual se propuso analizar las variaciones en los niveles de anticuerpos IgG posvacunación en distintas cohortes de adultos e identificar los factores que influyen en estas variaciones.
Un aspecto de interés esencial fue la evaluación comparativa de esquemas de vacunación homólogos y heterólogos. De los estudios revisados, siete se centraron específicamente en esta comparación; la consistencia en los hallazgos es notable: la administración de dos dosis homólogas de la vacuna de Pfizer consistentemente produjo los niveles más elevados de anticuerpos IgG, con títulos geométricos medios (TGM) superiores a 700 AU/mL. En cuanto a las estrategias heterólogas, el 12.5% de estos estudios reportaron que la combinación de una dosis de Pfizer seguida de una dosis de Moderna demostró una mayor eficacia protectora6,7,8,9,10,11,12. Sin embargo, la mayoría de los estudios (87.5%) indicaron que el esquema de dos dosis de Sinovac, seguido de dos dosis de Pfizer, resultó en los niveles más altos de anticuerpos IgG, consolidándose como el esquema más eficiente en términos de magnitud de la respuesta inmune.
Los resultados de Kodde et al. (2023) complementan estos hallazgos al señalar que el esquema homólogo con dos dosis de Moderna generó la media más alta de anticuerpos (383.4 AU/mL), superando al esquema heterólogo AstraZeneca + Pfizer (136.12 AU/mL). Las dos dosis de Pfizer también indujeron niveles significativamente altos (media de 135 AU/mL). En contraste, el esquema homólogo con dos dosis de AstraZeneca mostró la media más baja (57.58 AU/mL). Estos datos subrayan la variabilidad en la respuesta inmune según el tipo y esquema de vacuna, y sugieren que el esquema heterólogo AstraZeneca + Pfizer y el homólogo con Moderna podrían inducir una producción superior de anticuerpos a diferencia de otras combinaciones13.
Similar a esta investigación, Kittikraisak et al. (2022) investigaron los niveles de anticuerpos IgG contra el SARS-CoV-2 en profesionales de la salud tailandeses; sus resultados mostraron que, con dos dosis de AstraZeneca, solo el 32% de los participantes alcanzó niveles ≥264 BAU/ml, mientras que, con Sinovac, este porcentaje fue ligeramente superior al 8%. Es importante destacar que, con la combinación heteróloga de una dosis de AstraZeneca y una dosis de Pfizer, el 100% de los participantes lograron niveles ≥264 BAU/ml. Además, el esquema de dos dosis de Sinovac seguido de una dosis de Pfizer indujo niveles de anticuerpos más altos (3423 BAU/ml) en comparación con dos dosis de Sinovac seguidas de una de AstraZeneca (2105 BAU/ml) cuatro semanas después de la vacunación. Si bien los niveles de anticuerpos en el grupo que recibió dos dosis de Sinovac más dos de AstraZeneca disminuyeron por debajo del límite de detección en 228 días, aquellos con dos dosis de Sinovac más dos de Pfizer mantuvieron anticuerpos detectables14. Esto sugiere que las combinaciones heterólogas pueden generar una mayor respuesta inmunitaria y con una duración persistente de la protección en relación con los esquemas homólogos.
La duración de la respuesta inmunitaria y la subsiguiente disminución de los niveles de anticuerpos IgG son aspectos críticos para comprender la protección a largo plazo conferida por las vacunas contra el COVID-19. El análisis de estos 116 estudios reveló que el 91.78% se centraron en la vacuna de Pfizer. Estas investigaciones consistentemente demostraron que los niveles de anticuerpos IgG alcanzaron su pico máximo, aproximadamente 8621 AU/mL, cuatro semanas después de la segunda dosis. Sin embargo, se observó una disminución progresiva a partir de las ocho semanas, con valores cayendo por debajo de 500 AU/mL después de nueve meses de seguimiento.
La vacuna de AstraZeneca, abordada en el 20.69% de todos los estudios analizados, mostró un pico de eficacia de alrededor de 2500 AU/mL un mes después de la tercera dosis. Por su parte, la vacuna Moderna, mencionada en el 12.93%, exhibió un pico de 3291 AU/mL un mes después de la segunda dosis, con una posterior disminución de los niveles de anticuerpos a partir de los 240 días.
En el caso de la vacuna Sinovac, que representó el 11.21% de las investigaciones, se observó un pico de 1012 AU/mL después de la segunda dosis, pero los niveles comenzaron a declinar a los cuatro meses. Es relevante señalar que algunos estudios que consideraron el género como un factor encontraron diferencias en la eficacia de Sinovac; reportaron 169 AU/mL para hombres y 98 AU/mL para mujeres.
Las vacunas Sputnik y Kconvac, cada una mencionada en el 1.76% de los estudios, alcanzaron picos máximos de eficacia de 2148 AU/mL y 1617 AU/mL, respectivamente, después de la segunda dosis. Por último, las vacunas menos frecuentes en la literatura, Covaxin y Medigen, representaron el 0.86% de los estudios cada una. Covaxin alcanzó su pico aproximadamente dos meses después de la segunda dosis, mientras que Medigen demostró un aumento de 86 veces con respecto al valor inicial después de la segunda dosis.
En este contexto, el estudio de Liu et al. (2021) es notable por su análisis de los Títulos Medios Geométricos (GMT) de anticuerpos para evaluar la eficacia de la vacuna de ARNm KCONVAC en adultos de 18 a 59 años. La administración de dos dosis homólogas de KCONVAC generó un aumento sustancial del GMT, de 2.0 a 45.7, indicando una mayor respuesta inmune dentro de los 240 días posteriores a la segunda dosis. Este incremento superó el umbral de cuatro veces el valor inicial, lo que se considera seroconversión. Sin embargo, es crucial destacar que, en adultos mayores de 60 años, los GMT fueron significativamente más bajos, puesto que alcanzaron solo 18.3, lo que sugiere una respuesta inmune menos vigorosa en este grupo etario15.
Así mismo, diversos estudios han evaluado el título geométrico medio (TGM) de los anticuerpos IgG en diferentes momentos después de la administración de la primera dosis de la vacuna; en este sentido, autores como Van Praet et al. (2021) encontraron una disminución significativa del TGM en residentes de hogares de ancianos a lo largo del tiempo. Específicamente, el TGM fue de 1621 AU/mL en la semana 4, descendió a 1021 AU/mL en la semana 8 y a 218 AU/mL en la semana 24. Una tendencia similar se observó en trabajadores de la salud, donde el TGM disminuyó de 8677 AU/mL a 7760 AU/mL en la semana 8 y a 1607 AU/mL en la semana 2412. Estos hallazgos resaltan la preocupación de que, particularmente en pacientes ancianos, los niveles de anticuerpos IgG podrían no alcanzar o mantener niveles óptimos por un período prolongado después de la vacunación primaria.
No obstante, la importancia de las dosis de refuerzo es evidente en el estudio de Salvagno et al. (2022), que demostró la alta eficacia de una tercera dosis de refuerzo de la vacuna Pfizer/BioNTech para incrementar los niveles de anticuerpos IgG anti-SARS-CoV-2. Aunque se había observado un pico de 264 kBAU/L un mes después de completar el ciclo de vacunación primaria, la dosis de refuerzo indujo un segundo pico de concentración que alcanzó 8700 kBAU/L. Esto representó un aumento de 39 veces respecto a los niveles previos a la dosis de refuerzo y tres veces más alto que los valores del primer pico16. Estos resultados enfatizan el papel crucial de las dosis de refuerzo en la reactivación y el mantenimiento de una respuesta inmune amplia, especialmente frente al declive natural de los anticuerpos.
Conclusiones
Se ha observado consistentemente que la administración de esquemas homólogos con dos dosis de la vacuna de Pfizer tiende a generar los niveles más elevados de anticuerpos IgG. No obstante, los esquemas heterólogos, como la combinación de una dosis de Pfizer seguida de una dosis de Moderna, o el esquema de dos dosis de Sinovac seguidas de dos dosis de Pfizer, han demostrado ser notablemente eficientes en la inducción de altos títulos de anticuerpos. Estos hallazgos sugieren la importancia de considerar la flexibilidad en los esquemas de vacunación para maximizar la respuesta inmune, especialmente en contextos donde la disponibilidad de vacunas es variable.
La duración de la respuesta inmunitaria varía considerablemente entre los diferentes esquemas vacunales. Si bien la mayoría de las vacunas exhiben un pico de eficacia en los primeros meses posvacunación, los niveles de anticuerpos pueden disminuir con el tiempo. Por ejemplo, la vacuna de Pfizer, aunque alcanza su pico máximo después de la segunda dosis, muestra un descenso significativo en los niveles de anticuerpos a partir de las ocho semanas. Esta observación subraya la naturaleza transitoria de la protección humoral y la necesidad de estrategias para mantener la inmunidad a largo plazo.
En este sentido, la evidencia actual respalda firmemente la efectividad de las dosis de refuerzo para potenciar los niveles de anticuerpos IgG. La administración de una dosis de refuerzo ha demostrado inducir un segundo pico de concentración de anticuerpos, a menudo superando los niveles alcanzados con el esquema de vacunación primaria. Esto resalta la importancia crítica de considerar y promover las dosis adicionales para sostener la protección individual y comunitaria a lo largo del tiempo, especialmente frente a la emergencia de nuevas variantes virales y el declive natural de la inmunidad.
Es fundamental reconocer que la respuesta inmune puede variar significativamente según la edad y el género de los individuos. Se ha observado que los adultos mayores, en particular, pueden exhibir respuestas inmunes menos vigorosas en comparación con poblaciones más jóvenes. Esta variabilidad subraya la necesidad de adaptar las estrategias de vacunación a las características demográficas específicas de cada grupo poblacional, lo que podría incluir la consideración de dosis más altas, esquemas heterólogos específicos o intervalos de dosis ajustados para optimizar la protección en individuos vulnerables.
En síntesis, esta investigación ha proporcionado hallazgos fundamentales sobre la inmunogenicidad posvacunación contra el COVID-19 en la población adulta. Estos resultados no solo amplían la comprensión de la respuesta inmune inducida por las diferentes vacunas y sus esquemas, sino que también sientan las bases para la vigilancia continua de los niveles de anticuerpos y el desarrollo de estrategias de vacunación dinámicas y adaptativas que consideren la variación en la respuesta, la duración de la protección y la necesidad de dosis de refuerzo en diversos grupos poblacionales.
Conflictos de interés
Los autores de este artículo no poseen ningún conflicto de interés.
Referencias
- Khan M, Adil SF, Alkhathlan HZ, Tahir MN, Saif S, Khan M, Khan ST. COVID-19: A Global Challenge with Old History, Epidemiology and Progress So Far. Molecules. 2020;26(1):39. doi: 10.3390/MOLECULES26010039
- Instituto Nacional de Salud de Perú. Prevalencia, manifestaciones clínicas y factores asociados al desarrollo de COVID-19 de larga duración [Internet]. 2022 [cited 2025 May 29]. Disponible en https://fi-admin.bvsalud.org/document/view/273av
- Wu F, Zhao S, Yu B, Chen YM, Wang W, Song ZG, Hu Y, Tao ZW, Tian JH, Pei YY, Yuan ML, Zhang YL, Dai FH, Liu Y, Wang QM, Zheng JJ, Xu L, Holmes EC, Zhang YZ. A new coronavirus associated with human respiratory disease in China. Nature. 2020;579(7798):265–9. doi: 10.1038/s41586-020-2008-3
- Ministerio de Salud Pública del Ecuador. Incidencia semanal de casos confirmados COVID-19, Ecuador 2020-2023 [Internet]. Quito: Ministerio de Salud Pública del Ecuador; 2023 Ene 22 [citado 23 Jul 2025]. Disponible en: https://www.salud.gob.ec/wp-content/uploads/2023/01/MSP_ecu_cvd19_datos_epi_20230122_03h00.pdf
- Petersen MS, Pérez-Alós L, Armenteros JJA, Hansen CB, Fjallsbak JP, Larsen S, Hansen JL, Jarlhelt I, Kristiansen MF, við Streym F, á Steig B, Christiansen DH, Møller LF, Strøm M, Andorsdóttir G, Gaini S, Weihe P, Garred P. Factors influencing the immune response over 15 months after SARS‐CoV‐2 infection: A longitudinal population‐wide study in the Faroe Islands. J Intern Med. 2022;6. doi: 10.1111/JOIM.13560
- Moghnieh R, Abdallah D, Mekdashi R, El-Hassan S, Jisr T, Sayegh MH, et al. Immunogenicity and reactogenicity of BNT162b2 booster dose in individuals previously vaccinated with BBIBP-CorV versus homologous BNT162b2 vaccination: a pilot study. Vaccine. 2021 Oct 19;39(43):6418-24.
- Müller L, Andree M, Gil-Cruz C, Konigs C, Lengenfelder B, Mai MM, et al. Age-dependent immune response to the Biontech/Pfizer BNT162b2 Covid-19 vaccination. Clin Infect Dis. 2021 Jul 15;73(2):331-8.
- Vietri MT, Cozzolino L, Sasso M, Parente V, Di Mauro L, D’Angelo S, et al. Humoral immune response to BNT162b2 mRNA COVID-19 vaccine in healthcare workers. J Clin Virol. 2021 Nov;144:105057.
- Kitabatake M, Ito H, Suzuki Y, Kida H, Minamiyama M, Matsushita S, et al. Transition of antibody titers after SARS-CoV-2 mRNA vaccination in Japanese healthcare workers. J Jpn Infect Dis. 2022 May 25;96(3):215-9.
- Mastroianni F, Giannella M, Pasculli P, Camporese A, Giannini G, De Biase RV, et al. Antibody response after BNT162b2 mRNA vaccination in healthcare workers. J Vac Res. 2022 Jan 26;1(1):100175.
- Hibino M, Kawana M, Kato Y, Hayakawa M, Nishimura K, Kanai H, et al. A comparative study of two assays for SARS-CoV-2 spike protein antibody detection in Japanese healthcare workers after BNT162b2 mRNA vaccination. Intern Med. 2021 Sep 24;60(18):2921-5.
- Van Praet JT, Vandecasteele S, De Roo A, Vynck M, De Vriese AS, Reynders M. Dynamics of the Cellular and Humoral Immune Response After BNT162b2 Messenger Ribonucleic Acid Coronavirus Disease 2019 (COVID-19) Vaccination in COVID-19-Naive Nursing Home Residents. J Infect Dis. 2021;224(10):1690–3. doi: 10.1093/INFDIS/JIAB458
- Kodde C, Tafelski S, Balamitsa E, Nachtigall I, Bonsignore M. Factors Influencing Antibody Response to SARS-CoV-2 Vaccination. Vaccines. 2023;11(2):451. doi: 10.3390/VACCINES11020451/S1
- Kittikraisak W, Hunsawong T, Punjasamanvong S, Wongrapee T, Suttha P, Piyaraj P, Leepiyasakulchai C, Tanathitikorn C, Yoocharoen P, Jones AR, Mongkolsirichaikul D, Westercamp M, Azziz-Baumgartner E, Mott JA, Chottanapund S. Anti-SARS-CoV-2 IgG antibody levels among Thai healthcare providers receiving homologous and heterologous COVID-19 vaccination regimens. Influenza Other Respir Viruses. 2022;16(4):662–72. doi: 10.1111/IRV.12975
- Liu J, Huang B, Li G, Chang X, Liu Y, Chu K, Hu J, Deng Y, Zhu D, Wu J, Zhang L, Wang M, Huang W, Pan H, Tan W. Immunogenicity and Safety of a 3-Dose Regimen of a SARS-CoV-2 Inactivated Vaccine in Adults: A Randomized, Double-Blind, Placebo-Controlled Phase 2 Trial. J Infect Dis. 2021;225(10):1701–9. doi: 10.1093/INFDIS/JIAB627
- Salvagno GL, Henry BM, Pighi L, De Nitto S, Gianfilippi G, Lippi G. Effect of BNT162b2 booster dose on anti-SARS-CoV-2 spike trimeric IgG antibodies in seronegative individuals. Clin Chem Lab Med. 2022;60(6):930–3. doi: 10.1515/cclm-2022-0212
- Hu X, Guo R, Qi Z, Zhang Y, Li W, Hao C. Genetic screening reveals hotspot variants and prevalence rates of Hermansky-Pudlak syndrome in the Chinese population. Clinica Chimica Acta. 2024;561:119813. https://doi.org/10.1016/J.CCA.2024.119813
Cómo citar el presente artículo:
Santiago-Villarreal V, Villalba-Lozano A. Niveles de anticuerpos IgG en adultos tras la vacunación anti-COVID-19: una revisión bibliográfica. Revisión bibliográfica. Indexia. Agosto 2025.
Todos los artículos se publican bajo la licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0), lo que permite compartir y adaptar el contenido siempre que se dé el crédito adecuado a los autores y a la revista.
