REPORTE DE CASO
Tumor del estroma gastrointestinal de yeyuno
Gastrointestinal stromal tumor of the jejunum
Md. Tatiana Vallejo Paccha 1; Dr. Lenin Albán Ortega 2
1 Servicio clínica 2. Hospital Manuel Ygnacio Monteros, Loja, Ecuador 2 Servicio clínica 2. Hospital Manuel Ygnacio Monteros, Loja, Ecuador
PALABRAS CLAVE:
tumores estromales gastrointestinales
KEYWORDS:
gastrointestinal stromal tumors
Resumen
Se denominan tumores del estroma gastrointestinal a los tumores mesenquimales, fusiformes o epitelioides, primarios del tracto digestivo, mesenterio y retroperitoneo (1). Son sarcomas que, en su mayoría, derivan de precursores de las células intersticiales de Cajal, las células marcapasos del tracto gastrointestinal tracto responsable de su motilidad (2) (5). Estos tumores se presentan asintomáticamente en la generalidad de los casos, especialmente en los más pequeños del tracto intestinal, y son diagnosticados incidentalmente durante una exploración endoscópica o imágenes radiológicas por un propósito diferente o durante cirugía (3). Los pacientes sintomáticos pueden mostrar síntomas inespecíficos: náuseas, vómitos, dolor abdominal distensión, saciedad temprana, dolor abdominal y rara vez como masa abdominal palpable (4). Se expone el reporte de caso de mujer de 72 años con antecedentes de hipertensión arterial y anemia, que acude por dolor intenso en epigastrio, tipo urente, acompañado de deposiciones diarreicas en abundante cantidad en concho de café con coágulos. Permanece hospitalizada durante 18 días por hemorragia digestiva alta. Se realiza angiotomografía axial computarizada de aorta abdominal, laparotomia exploratoria más exceresis de hemangioma y resección de yeyuno. Se envió muestra para estudio histopatológico e inmunohistoquímico.
Palabras clave
tumores estromales gastrointestinales
Abstract
Gastrointestinal stromal tumor, is defined as primary mesenchymal, spindle-shaped or epithelioid tumors of the digestive tract, mesentery, and retroperitoneum (1). They are sarcomas that mostly derive from precursors of the interstitial cells of Cajal, the pacemaker cells of the gastrointestinal tract responsible for its motility (2). GISTs present asymptomatically in 18% of cases, especially in cases of smaller tumors of the intestinal tract and are diagnosed incidentally during an endoscopic exploration, on radiological imaging for a different purpose, or during surgery (3) (15). Symptomatic patients may present nonspecific symptoms: nausea, vomiting, abdominal pain, bloating, early satiety, abdominal pain, and rarely as a palpable abdominal mass (4). A case report of a 70-year-old woman with history of arterial hypertension and anemia; He came due to intense burning pain in the epigastrium accompanied by abundant diarrheal stools in coffee cones with clots. She remains hospitalized for 18 days due to upper gastrointestinal bleeding. Computerized axial tomography angiography of the abdominal aorta, exploratory laparotomy was performed plus excision of the hemangioma and jejunum resection. Sample was sent for histopathological and immunohistochemical study.
Keywords
gastrointestinal stromal tumors
Introducción
La denominación de tumor del estroma gastrointestinal (GIST) fue utilizada por vez primera, en 1983, por Mazur y Clark, para designar unos tumores no epiteliales del tubo digestivo que carecían de rasgos ultraestructurales de músculo liso y características inmunohistoquímicas de células de Schwann. Originalmente, se creía que eran un sarcoma de músculo liso, y se denominaron leiomioma y leiomiosarcoma; ahora se sabe que se producen a partir de las células intersticiales de Cajal (células de marcapasos intestinales) (6). Pueden originarse en cualquier sitio a lo largo del tracto digestivo, pero sus localizaciones más frecuentes son el estómago (50-60%), intestino delgado (30-35%), y son menos frecuentes en colon y recto (5%) y en esófago (<1%) (1). Los casos encontrados en otras localizaciones de la cavidad abdominal corresponden al omento, mesenterio y retroperitoneo, vesícula biliar y vejiga urinaria (<5%), que, en ocasiones, son resultado de metástasis de un GIST primario no detectado (6).
Generalmente, los GIST son causados en gran parte por mutaciones en el receptor de tirosina quinasa KIT y/o receptor-α del factor de crecimiento derivado de plaquetas (PDGFR-α) y, en casos raros, en otros genes como neurofibromina 1 (NF1), succinato deshidrogenasa (SDH) o BRAF (7) (8) (9). La incidencia anual varía entre 10 y 20 casos por millón de habitantes (9).
La edad media de aparición es alrededor de los 60 a 69 años sin predilección de sexo, aunque puede observarse en pacientes jóvenes, sobre todo asociado a síndromes que predisponen el desarrollo de estos tumores (9). Se reporta, en la mayoría de los casos, como una enfermedad esporádica en la cual no puede establecerse relación con un factor de riesgo causal. Sin embargo, algunos GIST surgen en relación con síndromes específicos, como son las mutaciones hereditarias en el gen KIT; asimismo, exones 8, 11, 13 o 17 confieren un alto riesgo de desarrollar GIST de estómago o intestino delgado en edades tan tempranas como 18 años. Las mutaciones hereditarias de PDGFRA se asocian a un elevado riesgo de presentar GIST y frecuentemente desarrollan pólipos inflamatorios de localización gástrica y en intestino delgado (10). La asociación de GIST gástrico, paraganglioma y condroma pulmonar, conocida como triada de Carney, es una condición rara no hereditaria que se presenta mayormente en niñas y mujeres jóvenes (10).
Por otra parte, las manifestaciones clínicas varían según la localización y el tamaño del tumor. Los GIST de pequeño tamaño suelen ser asintomáticos; sin embargo, en ausencia de complicaciones, como hemorragia digestiva alta/hemoperitoneo, perforación tumoral, obstrucción intestinal o ictericia obstructiva, la sintomatología es inespecífica (saciedad precoz, anemia, dolor abdominal, tumefacción. La manifestación más frecuente es el sangrado gastrointestinal, que puede acompañarse de anemia, melena o hematemesis. Los tumores grandes pueden causar distensión abdominal, obstrucción de la luz gastrointestinal (tumores con crecimiento endófito) o compresión del tracto gastrointestinal (GIST con crecimiento endofítico). Cuando se trata de los GIST esofágicos, el primer síntoma específico que se encuentra es la disfagia (14).
En este contexto, el examen endoscópico tiene un papel esencial en el diagnóstico porque permite la visualización directa del tumor, con la posibilidad de tomar biopsias para el examen patológico. Los GIST pueden surgir como tumores con márgenes lisos ubicados en la submucosa, con una cubierta mucosa normal que sobresale hacia la luz del tubo digestivo. En algunos casos, se puede ver una ulceración central (14).
Una segunda técnica para detectar esta clase de tumores es la ultrasonografía endoscópica (USE), la cual ayuda a evaluar la invasión dentro de la pared gastrointestinal e identificar la capa del tracto digestivo como origen del GIST. Por lo tanto, con mayor frecuencia, estos tumores se originan en la muscularis propia y también pueden originarse pequeñas lesiones en la muscularis mucosa. Adicionalmente, los GIST se presentan como un tumor hipoecoico, homogéneo, de bordes bien definidos, rara vez irregular, y, a veces, con úlceras asociadas. Este estudio igualmente facilita tanto las biopsias guiadas como la diferenciación de GIST a otros tumores submucosos (14).
Otro procedimiento utilizado en el diagnóstico de los GIST es la tomografía axial computarizada (TAC) con contraste, que es el método de imagen de elección para el estudio de extensión y seguimiento de los GIST, ya que permite identificar y describir las neoplasias. De igual modo, este prueba sirve para evaluar su extensión y la presencia de enfermedad metastásica, así como tambiénposibilita el diagnóstico diferencial, la evaluación de la respuesta al tratamiento y la identificación de recurrencia del tumor (14).
Además de los anteriores métodos, tenemos la resonancia magnética (RM), que se utiliza como complemento en GIST de recto para visualizar relación con otras estructuras, también se indica para evaluación de lesiones hepáticas indeterminadas en la TAC y en casos donde la TAC está contraindicada. En la imagen por TAC, el tumor puede apreciarse como una masa exoluminal bien determinada que, luego de la administración de contraste, muestra un realce heterogéneo, sobre todo en los tumores de gran tamaño, los cuales pueden tener áreas de necrosis. La tomografía por emisión de positrones puede emplearse para seguimiento y evaluación de respuesta al tratamiento (11).
Sin embargo, el diagnóstico definitivo es histopatológico. Las muestras se pueden obtener durante la exploración endoscópica, la escisión laparoscópica o la laparotomía. En el caso de metástasis, las muestras para diagnóstico histopatológico también pueden obtenerse mediante biopsia de las metástasis. El diagnóstico se confirmó utilizando histología e inmunohistoquímica estándar para la expresión de c- kit o DOG1 (14) (15).
Actualmente, la resección quirúrgica radical es el estándar de oro para los GIST del intestino delgado (12). Las guías clínicas recomiendan imatinib en pacientes con GIST de alto grado en el postoperatorio y en casos de recurrencia (15).
El imatinib está aprobado como tratamiento de primera línea para pacientes con GIST avanzado o metastásico. La dosis estándar de este medicamento es de 400 mg diarios y se administra a todos los tipos de GIST metastásicos o avanzados, excepto a los pacientes que tienen una mutación en el exón 18 D842V de PDGFRA o mutaciones en el exón 9 de c-KIT. Después de la progresión con 400 mg de imatinib, es posible aumentarla a una dosis de 800 mg, si se tolera. Potencialmente, puede conducir a un efecto de tratamiento secuencialmente prolongado antes de cambiar al tratamiento de segunda línea (17).
En el caso de los pacientes con GIST que albergan mutaciones en el exón 9 de c-KIT, se debe administrar 800 mg de imatinib al día. Asimismo, cuando se trata de pacientes con GIST avanzado o metastásico, se recomienda sunitinib como tratamiento de segunda línea, y puede usarse en regímenes de dosificación intermitente o continua.
Regorafenib es un medicamento que está prescrito como tratamiento de tercera línea en pacientes con GIST avanzado o metastásico. Así también, tenemos el ripretinib, que ha sido aprobado por la FDA como tratamiento de cuarta línea en pacientes con GIST avanzado (17).
Los pacientes con GIST que albergan una mutación en PDGFRA exón 18 D842V pueden tratarse con avapritinib, que se validó recientemente.
Al igual que otros tumores, el GIST también puede hacer metástasis hacia otros sitios del cuerpo. La metástasis hepática y la diseminación peritoneal son los dos principales patrones metastásicos de GIST y, además, los pulmones, los huesos, el cerebro. La metástasis ósea o pulmonar de GIST es rara (13).
Por otro lado, el pronóstico de GIST está determinado por el tamaño del tumor, la tasa mitótica, la ubicación del tumor, la ruptura o el margen afectado del tumor (15). Algunos casos de GIST del intestino delgado pueden tener un muy buen curso clínico. Sin embargo, en muchos casos, el cuadro clínico puede deteriorarse rápidamente y puede presentarse morbilidad y mortalidad a pesar del tratamiento quirúrgico (16).
Caso clínico
Mujer de 72 años, ama de casa, procedente de la ciudad de loja, con antecedentes clínicos de hipertensión arterial, en tratamiento con amlodipino de 5 mg y losartan de 50 mg diarios, y quirúrgicos de colecistectomia de hace 4 años, acude por presentar desde hace 16 horas dolor abdominal intenso localizado en epigastrio, tipo urente, en la escala de Eva 6/10, no cede con cambios posturales, concomitantemente realiza deposición diarreica abundante aproximadamente de 200 ml en concho de café con coágulos, acude a establecimiento de salud. Durante valoración en emergencia, realiza nuevo episodio hemorrágico en moderada cantidad y vómitos de características biliosas por 3 ocasiones, se decide su ingreso al servicio de Gastroenterología para diagnóstico y manejo clínico.
Tabla 1. Analítica de monitoreo en estancia hospitalaria
Al examen físico, registra las siguientes constantes vitales: TA: 109/52 mmhg FC: 90 lpm, FR: 19 x min, SpO2: 94% con FiO2 al 21%, temperatura 37.3°C. Paciente en decúbito dorsal activo, se observa palidez generalizada, mucosas orales húmedas, cuello no se evidencia presencia de ingurgitación yugular. Tórax: elasticidad y expansibilidad conservada, a la auscultación, corazón: R1-R2 rítmico, no se encuentran soplos; pulmones: murmullo vesicular conservado. Abdomen: presencia de cicatriz en región infraumbilical de aproximadamente 7 cm, ruidos hidroaéreos presentes; suave, depresible, doloroso a la palpación a nivel de epigastrio y mesogastrio. Extremidades superiores: tono y fuerza en escala de Daniels 4/5, no presencia de edemas; inferiores: tono y fuerza en escala de Daniels 3/5, no presencia de edema.
A su ingreso, se realizan exámenes de laboratorio: hemoglobina 6.80 g/dL; hematocrito 21.80%. Se transfunden dos concentrados de glóbulos rojos.
Evolución
Paciente ingresa al servicio de Gastroenterología, se decide tratamiento con inhibidores de la bomba de protones como omeprazol y antiemético como metoclopramida. Durante su hospitalización, se evidencia deposiciones melénicas por varias ocasiones, de moderada cantidad, que ocasionaron que disminuya hemoglobina y hematocrito, por lo que se transfundieron en total 10 concentrados globulares, presentando reacción postransfusional por 4 ocasiones, además, vómitos de contenido biliar con leve dolor abdominal localizado en epigastrio, de gran intensidad, tipo urente.
A su segundo día de hospitalización, se realiza endoscopia digestiva alta que reporta mucosa gástrica eritematosa en toda su extensión con algunas erosiones planas de aspecto nodular en cuerpo gástrico, sin sitios de sangrado activo hasta segunda porción de duodeno. (imagen 1). Se reporta aumento de temperatura de 38.3ºC, por lo que se solicita PCR, EMO más urocultivo y prueba de Sarscov2 la cual resulta negativa.
Imagen 1. Exploración endoscópica
Debido a persistencia de melenas, se decide realizar colonoscopia para determinar origen hemorrágico determinándose mucosa, luz, haustras y patrón vascular normales, con restos hemáticos digeridos a nivel de fondo de ciego (imagen 2). Región anal: de características normales.
Imagen 2. Restos hemáticos
Paciente cursando su cuarto día de hospitalización, en el que se evidencia desaturaciones hasta llegar a 82% sin oxígeno, temperatura de 38,5ºC, taquicárdica FC:109, despierta, lúcida, orientada, responde a interrogatorio de manera coherente, obedece órdenes. Piel con palidez generalizada, diaforética. Se realiza control de biometría hemática en la cual se evidencia Hb:5.8 g/dL, Hcto:18.10%, por lo que se decide transfundir dos paquetes de glóbulos rojos.
En los dias siguientes, se evidencia nuevos episodios de deposiciones diarreicas en concho de café, por cual se realiza interconsulta a Cirugía General. Se toma muestras de pancultivos para estudios complementarios.
Al décimo día de hospitalización, control de hemoglobina 7.50 g/dL, hematocrito 23.20%, continúa con diagnóstico de hemorragia digestiva a determinar origen. Se realiza angiotac de aorta abdominal con reporte en el hemiabdomen izquierdo, en proyección del yeyuno, formando una lesión lobulada de 21x32x43 mm de bordes definidos, asociado a presencia de vasos ligeramente dilatados y turtuosos, adyacentes a la lesión, los cuales confluyen y se dirigen hacia la vena porta. Conclusión: malformación arteriovenosa intestinal a nivel de yeyuno.
Imagen 3. Exploración tomográfica
MAV: malformación arterio-venosa. 25,91mm x 23,60
Se realiza laparotomía exploratoria (imagen 4) más exéresis de hemangioma, más resección de yeyuno 15 cm, más anastomosis primaria, encontrando adherencias de epiplon mayor a útero y anexos, firmes, hemangioma pediculado a nivel de yeyuno, a 30 cm del ángulo de treitz, mide 3 cm de diámetro (imagen 5) dependiente de borde antimesentérico. Se toma muestra para estudio histopatológico e inmunohistoquímico.
Imagen 4. Exploración quirúrgica
Imagen 5. Hemangioma pediculado
Luego de 19 días de hospitalización, paciente es dada de alta en condición estable.
A los dos meses de egreso, se da seguimiento por consulta externa de oncología. Paciente acude con resultado IHQ: 01/09/2022: ki 67 reactivo en 2-4% de núcleo de células, cd 117: positivo en células fusiformes, actina músculo liso positivo moderado en células fusiformes, cd 34 positivo en células fusiformes, s 100 negativo. Se diagnostica de tumor del estroma gastrointestinal (GIST) en yeyuno. Se requiere tratamiento adyuvante con imatinib, se realiza derivación a prestador externo para tratamiento oncológico.
Imagen 6. Tinción HE (Hematoxilina – Eosina). 4x.
Tumor en relación con la mucosa de colon. Se identifica tumor de ubicación submucosa, respeta la mucosa colónica.
Imagen 7. Tinción HE, 10x.
Células neoplásicas fusiformes, homogéneas, en un patrón fascicular y levemente arremolinado.
Imagen 8. Tinción HE, 40x.
Presencia de células con atipia degenerativa, no se reconoce mitosis ni marcación de Ki67 en estas células.
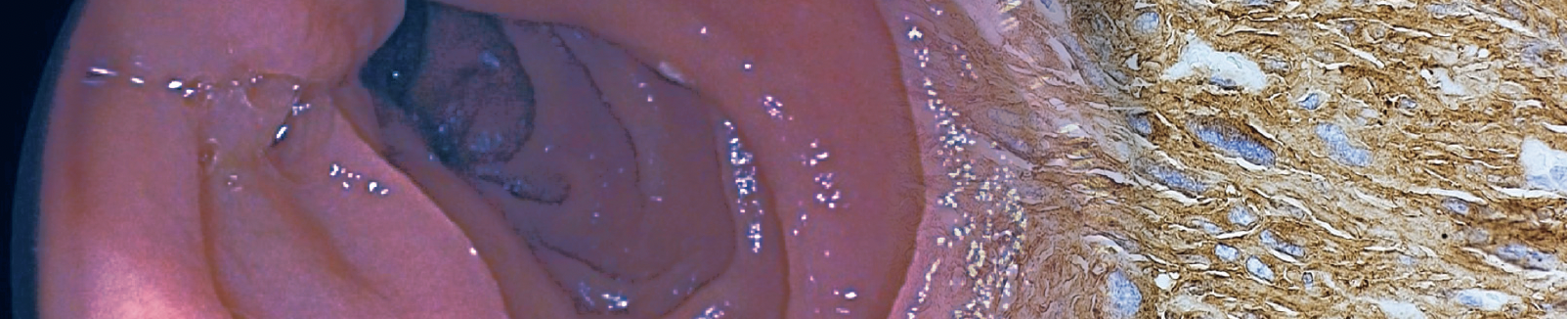
Imagen 9. Inmunohistoquímica CD117, 40x
Positivo intenso, difuso, citoplasmático
Discusión
El tumor del estroma gastrointestinal (GIST) es un tumor raro del intestino delgado.
La mayoría de los pacientes suelen reportar quejas prolongadas debido a diagnósticos difíciles. Sin embargo, la incidencia varía con la geografía; en la mayoría de los países, tienen una tasa de 10 y 20 casos por millón de habitantes (17). Se requiere un alto grado de sospecha para el diagnóstico precoz e inicio del manejo adecuado (12). En el presente caso, la edad se encuentra por sobre el rango reportado en la literatura, esta indica que, en el momento del diagnóstico, está entre 60 y 69 años en la mayoría de los estudios (9).
La manifestación más frecuente es el sangrado gastrointestinal, que puede acompañarse de anemia, melena o hematemesis (12) (19); otros autores mencionan que los síntomas más frecuentes fueron sangrado (50%) y dolor (37,5%). El 5% de los pacientes estaban asintomáticos y el 67,5% estaban en el grupo de alto riesgo (16), datos que concuerdan con el caso reportado.
Los pacientes se evalúan mediante endoscopia GI superior, ecografía endoscópica (EUS) y tomografía computarizada con contraste (CECT) del abdomen y la pelvis (para evaluar la metástasis) (6). En caso actual, la endoscopia alta realizada fue normal, posteriormente, al realizar colonoscopia, se evidenciaron restos hemáticos a nivel de fondo de ciego. La angiotomografia de abdomen realizada permitió la localización de la lesión, en estudios realizados, angiografía mesentérica fue diagnóstica, y reveló una lesión vascular intestinal; dos estudios previos han confirmado la eficacia y viabilidad de la angiografía por TC en el diagnóstico de tales lesiones, con una sensibilidad del 90,9% para los GIST del intestino delgado (6). El diagnóstico se confirma mediante biopsia con inmunohistoquímica positiva para CD117, CD34 o PDGFRA. Algunos GIST también expresan positividad para DOG1 (6), lo cual se corrobora con la inmuhistoquímica realizada a la paciente.
La resección quirúrgica de un GIST localizado es la clave de la terapia, el propósito de la cirugía GIST es proporcionar una resección completa para reducir la posibilidad de recurrencia y el desarrollo de metástasis. Se ha informado que la resección completa afecta el pronóstico en los casos de GIST; en estudios realizados, informaron que la resección completa se logró en el 70% de los pacientes, por lo que exéresis del tumor en la paciente fue la mejor medida terapeútica (16) (18). En este caso, se realizó laparotomía exploratoria más exéresis de hemangioma, más resección de yeyuno 15 cm, más anastomosis primaria sin complicaciones.
Conclusiones
La sospecha diagnóstica inicial, más la corroboración con estudios de imagen y exploración, permitieron ofrecerle a la paciente la resolución quirúrgica recomendada por las guías, así como el tratamiento complementario que garantizaron su recuperación total.
Financiamiento
Los autores no recibieron financiación para el desarrollo de la presente investigación.
Conflicto de interés
Los autores declaran que no existe conflicto de intereses.
1. Akahoshi K, Oya M, Koga T, Shiratsuchi Y. Current clinical management of gastrointestinal stromal tumor. World J Gastroenterol. 2018 [acceso: 22/07/2019];24(26):2806-17. Disponible en https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6048423/
2. Parab TM, DeRogatis MJ, Boaz AM, Grasso SA, Issack PS, Duarte DA, et al. Gastrointestinal stromal tumors: A comprehensive review. J Gastrointest Oncol. 2019;10(1):144–54. Disponible en https://doi.org/10.21037/jgo.2018.08.20
3. Scola D, Bahoura L, Copelan A, et al. Getting the GIST: a pictorial review of the various patterns of presentation of gastrointestinal stromal tumors on imaging. Abdom Radiol (NY) 2017;42:1350-64.
4. Al-Share B, Alloghbi A, Al Hallak MN, Uddin H, Azmi A, Mohammad RM, et al. Gastrointestinal stromal tumor: a review of current and emerging therapies. Cancer Metastasis Rev. 2021;40(2):625–41. Disponible en https://doi.org/10.1007/s10555-021- 09961-7
5. Canelo A, Llanos Salirrosas A, Lopez E, Mantilla J, Mejía L, Polo S. Case report: Gastrointesinal stromaal tumor (GIST) in the jejunum. Rev Fac Md Hum. 2023; 23 (1): 138-142.doi 10.25176/ RFMH.v23iL5309
6. Tanweerul Huda, Mahendra Pratap Singh. Gastrointestinal Stromal Tumors of Small Intestine. Original Article CC BY 4.0 · Surg J (N Y) 2019; 05(03): e92-e95 DOI: 10.1055/s-0039-1694704
7. Jaros, D., Bozic, B. & Sebesta, C. Gastrointestinale Stromatumoren (GIST). Wien Med Wochenschr (2022). https://doi.org/10.1007/s10354-022-00965-8.
8. Saraireh, H., Tayyem, O., Al Asad, O. et al. A Rare Case of a Metastatic Gastrointestinal Stromal Tumor (GIST): a Case Report and Review of the Literature. J Gastrointest Canc 50, 926–934 (2019) https://doi.org/10.1007/s12029-017-0037-4
9. Waidhauser J, Bornemann A, Trepel M, Märkl B. Frecuencia, localización y tipos de neoplasia asociada a tumores del estroma gastrointestinal. World J Gastroenterol 2019; 25(30): 4261-4277 URL: https://www.wjgnet.com/1007-9327/full/v25/i30/4261.htm (https://www. wjgnet.com/1007-9327/full/v25/i30/4261.htm) DOI: https://dx.doi.org/10.3748/wjg.v25. i30.4261
10. Soriano-Lorenzo J, Lima-Pérez M, Soriano-García J, Zaldívar-Blanco K, Fleites-Calvo V. Tumores del estroma gastrointestinal. An Fac med. 2019;80(2):214-21.DOI: https:// 10.15381/ anales.802.16418
11. Casali PG, Abecassis N, Bauer S, Bielack S, Bonvalot S, Boukovinas I, et al. Gastrointestinal stromal tumours: ESMO-EURACAN clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018; 0(suppl 0):iv1-iv11. DOI: 10.1093/ annonc/mdy095.
12. Hosam Hamed, Mohamed Abdel Wahab, Youssif Elmahdy , Rihame M. Abd El-Wahab, y El-Sayed Abou El-Magd. Tumores del estroma gastrointestinal del intestino delgado: el desafíoo del diagnóstico y el resultado del manejo. Cirugía Oncológica Mundial J. 2023; 21: 85. Publicado en línea el 9 de marzo de 2023. doi: 10.1186/s12957-023-02968-0
13. Yang, D.Y., Wang, X., Yuan, W.J. et al. Metastatic pattern and prognosis of gastrointestinal stromal tumor (GIST): a SEER- based analysis. Clin Transl Oncol 21, 1654–1662 (2019). https:// doi.org/10.1007/s12094-019-02094-y
14. Gheorghe,G.;Bacalbasa, N.; Ceobanu, G.; Ilie, M.; Enache, V.; Constantinescu, G.; Bungau, S.; Diaconu, C.C. Gastrointestinal Stromal Tumors—A Mini Review. J. Pers.Med.2021,11,694. https:// doi.org/10.3390/jpm11080694
15. Lopez Gordo, S., Bettonica, C., Miró, M. et al. Gastric and Small Intestine Gist: Results of 156 Cases in 20 Years. J Gastrointest Canc 53, 451–459 (2022). https://doi.org/10.1007/s12029- 021-00641-x
16. Hakan Uzunoglu, Yasin Tosun, Ozan Akinci, Baver Baris. Departamento de Cirugía General, Kartal Dr. Lütfi Kırdar City Hospital, Estambul, Turquía. Tumores del estroma gastrointestinal del intestino delgado. Revista del Colegio de Médicos y Cirujanos de Pakistán. doi: 10.29271/ jcpsp.2021.12.1487
17. Brinch Charlotte Margareta, Ninna Aggerholm-Pedersen, Estrid Hogdall, Anders Krarup-Hansen. Medical oncological treatment for patients with Gastrointestinal Stromal Tumor (GIST) – A systematic review. Critical Reviews in Oncology / Hematology 172 (2022) 103650
18. Kassimi Mariam, Berrada Sofía, Habia Jihane, Guerroum Hind, Chihabeddine Meryeme, Mahi Mohamed. Tumor del estroma gastrointestinal del intestino delgado con metastasis pulmonar. Reporte de un caso. 2023. https://doi.org/10.1016/j.radcr.2021.09.065
19. Saad MK, Hajj IE, Saikaly E. Jejunal gastrointestinal stromal tumor (GIST): a case report presenting as life threatening emergency. Gastrointest Stromal Tumor [Internet]. el 20 de noviembre de 2020 [citado el 23 de noviembre de 2022];3(0). Disponible en https://doi. org/10.1016/j.ijsu.2014.02.004
20. ChunYuet Khoo, Xun Chai, Richard QUEK, Melissa CC Teo, Brian KP Goh. Revisión sistemática de los sistemas de pronóstico actuales para los tumores primarios del estroma gastrointestinal. Volumen 44, Edición 4, Abril 2018 , Páginas 388-394. https://doi.org/10.1016/j. ejso.2017.12.006
Como citar el presente artículo:
Vallejo T, Albán L. Tumor del estroma gastrointestinal de yeyuno. Reporte de caso. Indexia. Agosto 2023.
Artículos relacionados




Una perspectiva actual del Síndrome de Laron

¡Dengue! ¿Un encuentro casual?