REVISIÓN BIBLIOGRÁFICA

Una perspectiva actual del Síndrome de Laron
A current perspective on Laron syndrome
Jorge Ramírez-Robles 1 A; Milenka Zhindon-Ponce 1 B; Mikaela Gordillo-Placencia 1 C; Natalia Bailon-Moscoso 1,2 D.
1 Carrera de Medicina, Universidad Técnica Particular de Loja, Ecuador. San Cayetano alto s/n. CP 1101608
2 Departamento de Ciencias de la Salud, Universidad Técnica Particular de Loja, Ecuador. San Cayetano alto s/n. CP 1101608
Palabras Clave: Factor de crecimiento similar a la insulina 1, síndrome de Laron, Hormona de crecimiento, insensibilidad a la hormona de crecimiento.
Keywords: Insulin-like growth factor 1, Laron syndrome, Growth hormone, growth hormone insensitivity
Resumen
El síndrome de Laron es una endocrinopatía congénita rara, de tipo autosómica recesiva, caracterizada por la insensibilidad a los efectos biológicos de la hormona de crecimiento por mutaciones en las proteínas señalizadoras del receptor de la mencionada hormona, lo cual provoca, por un lado, la elevación de sus valores, y, por otro, niveles bajos del factor de crecimiento similar a la insulina 1; todo ello se traduce finalmente en baja estatura. Esta condición tiene una incidencia de 1 en cada 1 000 000 de nacidos vivos al año. A nivel mundial, hay aproximadamente 350 personas con este diagnóstico, de los cuales dos tercios están en Ecuador, en las provincias de Loja y El Oro, con una variante genética de origen mediterráneo.
La cohorte ecuatoriana es genotípicamente homogénea y no desarrollan cáncer ni diabetes mellitus tipo 2. La condición genética se sospecha ante la presencia de antecedentes familiares y relaciones de consanguinidad, además de características fenotípicas presentes desde el nacimiento. El diagnóstico bioquímico se realiza con las elevadas concentraciones basales y estimuladas de hormona de crecimiento junto con notables descensos de IGF-I e IGF-II.
El tratamiento con mecasermina ha demostrado eficacia evidenciada en un incremento en la estatura de los pacientes. Sin embargo, este medicamento es de difícil acceso debido a su escasez y elevado precio, por lo que su adquisición solo es posible mediante la intervención del Estado. Se destaca la necesidad de investigar nuevas terapias y explorar la implicación que tiene esta condición en áreas como el envejecimiento, metabolismo y oncología.
Abstract
Laron syndrome is a rare congenital endocrinopathy, autosomal recessive, characterized by insensitivity to the biological effects of growth hormone, due to mutations in the signaling proteins of the growth hormone receptor, which leads to elevated values of the itself, and low levels of insulin-like growth factor 1, ultimately translating into short stature. This condition has an incidence of 1 in every 1,000,000 live births per year. Worldwide, there are approximately 350 people with this diagnosis, of which two thirds in Ecuador, in the provinces of Loja and El Oro, with a genetic variant of Mediterranean origin.
The Ecuadorian cohort is genotypically homogeneous and does not develop cancer or type 2 diabetes mellitus. The genetic condition is suspected due to the presence of family history and consanguinity relationships, in addition to phenotypic characteristics present from birth. The biochemical diagnosis is made with high basal and stimulated concentrations of growth hormone along with notable decreases in IGF-I and IGF-II.
Treatment with mecasermin has demonstrated efficacy, evidenced by an increase in the height of patients. However, this medicine is difficult to access due to its scarcity and high price, so its acquisition is only possible through state intervention. The need to investigate new therapies and explore the implication that this condition has in areas such as aging, metabolism and oncology is highlighted.
Introducción
El síndrome de Laron (LS), conocido también como insensibilidad a la hormona del crecimiento (GHI), se trata de una condición genética autosómica recesiva, que se distingue por mutaciones en las proteínas señalizadoras del receptor de la hormona de crecimiento (GHR) y subunidad lábil al ácido (ALS), que produce crecimiento insuficiente por una falta de respuesta a la hormona de crecimiento (GH); de este modo resultan concentraciones séricas de GH altas y de factor de crecimiento insulínico tipo I (IGF-I) muy bajas (1). Estos hallazgos fueron descritos por primera vez por Zvi Laron, Athalia Pertzelan y Shoshana Mannheimer, en 1966, los cuales, al encontrar en 1958 una familia judía de origen yemenita, descendientes de una pareja de abuelos primos de primer grado, donde tres (dos hombres y una mujer) de los ocho nietos nacidos vivos presentaron dimorfismo facial (frente prominente, rostro pequeño, cabello escaso, obesidad e hipogonadismo), con concentraciones de GH elevadas y una talla anormalmente baja (2).
En 1981 se demostró que las propiedades fisicoquímicas de la unión de la GH a su receptor (GHR) eran similares tanto si se usaba GH extraída de personas sanas como si se obtenía la GH de personas afectadas por el LS, lo cual sugería un defecto en el GHR. Los mismos autores demostraron también que la GH normal no se unía al receptor hepático de los pacientes afectados. Por otra parte, rigurosos estudios posteriores comprobaron que la GH proveniente de estos pacientes se comporta con normalidad, ya sea inmunitaria o bioactivamente, demostrándose así que el defecto funcional en el síndrome de Laron reside en una anomalía del receptor para la GH (3).
A partir de ello, se han notificado múltiples casos de LS que han sido sujetos de estudio durante décadas, por tal razón, esta revisión tiene como objetivo la búsqueda, análisis y presentación de su incidencia en Ecuador, características clínicas, vías moleculares, tratamiento e investigaciones futuras en base a la menor predisposición genética de desarrollar cáncer o diabetes en esta población.
Epidemiología
El LS ocurre en aproximadamente 1 de cada 1 000 000 de nacidos vivos al año. Aunque no ha sido posible conocer el número exacto de casos a nivel mundial, se estiman más de 350 individuos con esta condición, de los cuales dos tercios se encuentran en Ecuador, asentados principalmente en las provincias de Loja y El Oro; el resto de los casos se encuentran distribuidos en otras zonas de América del Sur y en el mediterráneo (Israel, Arabia Saudita, Egipto e Irak) (4).
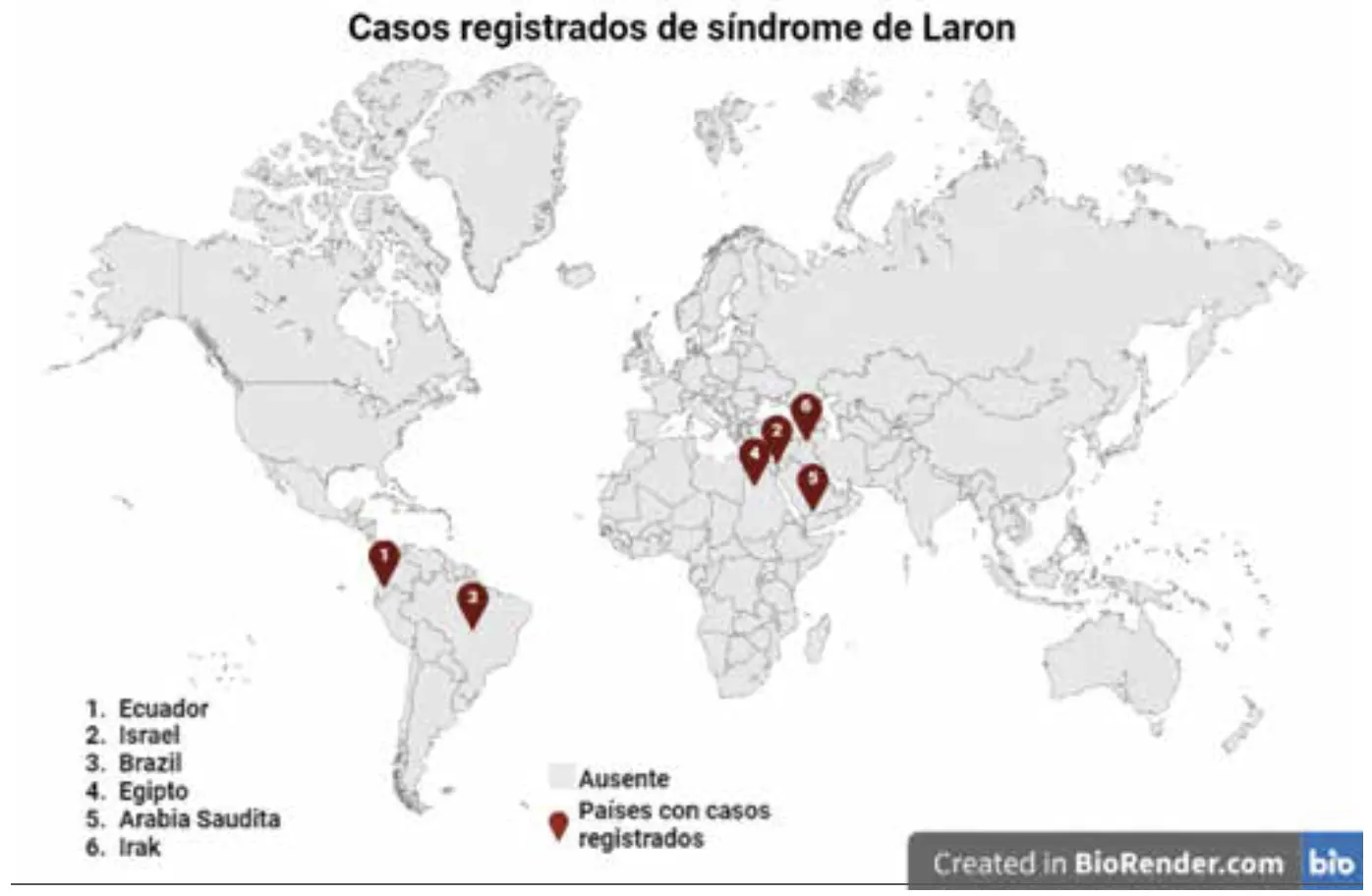
Figura 1. Distribución global del LS.
En la provincia de Loja, el LS tiene una relación 4:1 entre mujeres y varones; sin embargo, el grupo de El Oro no presenta un predominio sexual. Existe una hipótesis de que los pacientes de Laron en Ecuador son descendientes de judíos semíticos que escaparon durante la inquisición española, puesto que describen la misma variante que un paciente judío del norte de África (2). Vías moleculares implicadas en el LS La hormona liberadora de hormona del crecimiento (GHRH) es el principal neuropéptido hipofisótropo responsable de la generación y el mantenimiento de la secreción de GH pulsátil (1). Por otro lado, el GHR es un receptor transmembrana presente en diferentes tejidos del organismo (5). El nivel más alto de expresión de GHR se encuentra en el hígado, seguido de músculo, grasa, riñón y corazón (1) (Figura 3).
La GH, al unirse al GHR, activa una cascada de transducción de señales intracelulares para la producción y secreción de somatomedinas, especialmente del IGF1. Posteriormente, el IGF-1 llega a los tejidos que expresan su receptor (IGF1R). Luego, se reclutan proteínas adaptadoras y se fosforilan, con ello la señal es transmitida mediante dos vías: la vía del homólogo del virus del sarcoma de rata/fibrosarcoma rápidamente acelerado/proteína quinasa activada por mitógenos (RAS/RAF/MAPK) o la vía de fosfatidilinositol-4,5-bifosfato 3-quinasa/proteína quinasa/diana de mamífero de la rapamicina quinasa (PI3K/AKT/mTOR).
La primera vía se encarga de la proliferación celular, mientras que la segunda regula el crecimiento celular, el metabolismo y la apoptosis, a través de la inactivación de la proteína de muerte asociada al linfoma 2 proapoptótico de células B. A su vez, el IGF1 es el encargado de modular la secreción de GH en el eje hipotálamo-hipofisario, actuando como un mecanismo de retroalimentación negativa (6). Por ello, la variante en el gen que codifica el GHR en personas con LS altera los niveles hormonales y enzimáticos implicados en el eje GH/IGF-1, lo que, finalmente, resulta en personas de baja estatura con GH en niveles normales o altos y con niveles de IGF-1 bajos o indetectables (7).
Herencia y genética
El LS (OMIM#262500) es una condición genética con herencia autosómica recesiva, de tal manera que los progenitores tienen la variante patogénica del gen GRH, incluso cuando ninguno de ellos expresa características fenotípicas (Figura 2).
El gen GHR consta de 246 aminoácidos y 10 exones, siendo 9 de ellos codificantes, la variante del GHR se ubica en 5p13.1-p12 (subregión 1 de la región 13 a la región 12 del brazo corto del cromosoma 5), la transcripción de este fragmento de ADN se asocia a 74838 variantes alélicas (8).
La variante patogénica del empalme E180 en el exón 6, reportada en Ecuador y Brasil, es la más frecuente y es ocasionada por un error en el empalme de exones, debido a una sustitución de adenina por guanina, que desencadena la eliminación de ocho aminoácidos en la secuencia del gen de GHR (c.594A>G) (4,9).
Se han encontrado varios tipos de mutaciones en el gen del GHR: 27 por eliminación, 30 por duplicación, 2 por Indel, 7 por inserción y 284 por variación de un solo nucleótido. La gran mayoría de las mutaciones identificadas se localizan en el dominio extracelular de la GHR (10).
La proteína del GHR predomina en tejido hepático, aunque también se expresa en tejidos extrahepáticos en distintas proporciones. A nivel gastrointestinal (duodeno, intestino delgado, colon y recto), se encuentra en niveles altos, a excepción del estómago y del páncreas cuya presencia es baja. En lo que respecta al riñón, hipocampo, tiroides, glándulas suprarrenales, vesícula biliar, testículos, epidídimo, endometrio y amígdala, su existencia es media. Finalmente, su expresión es baja en la corteza cerebral, cerebelo, núcleo caudado, bronquios,
apéndice, paratiroides y nasofaringe (11) (Figura 3).
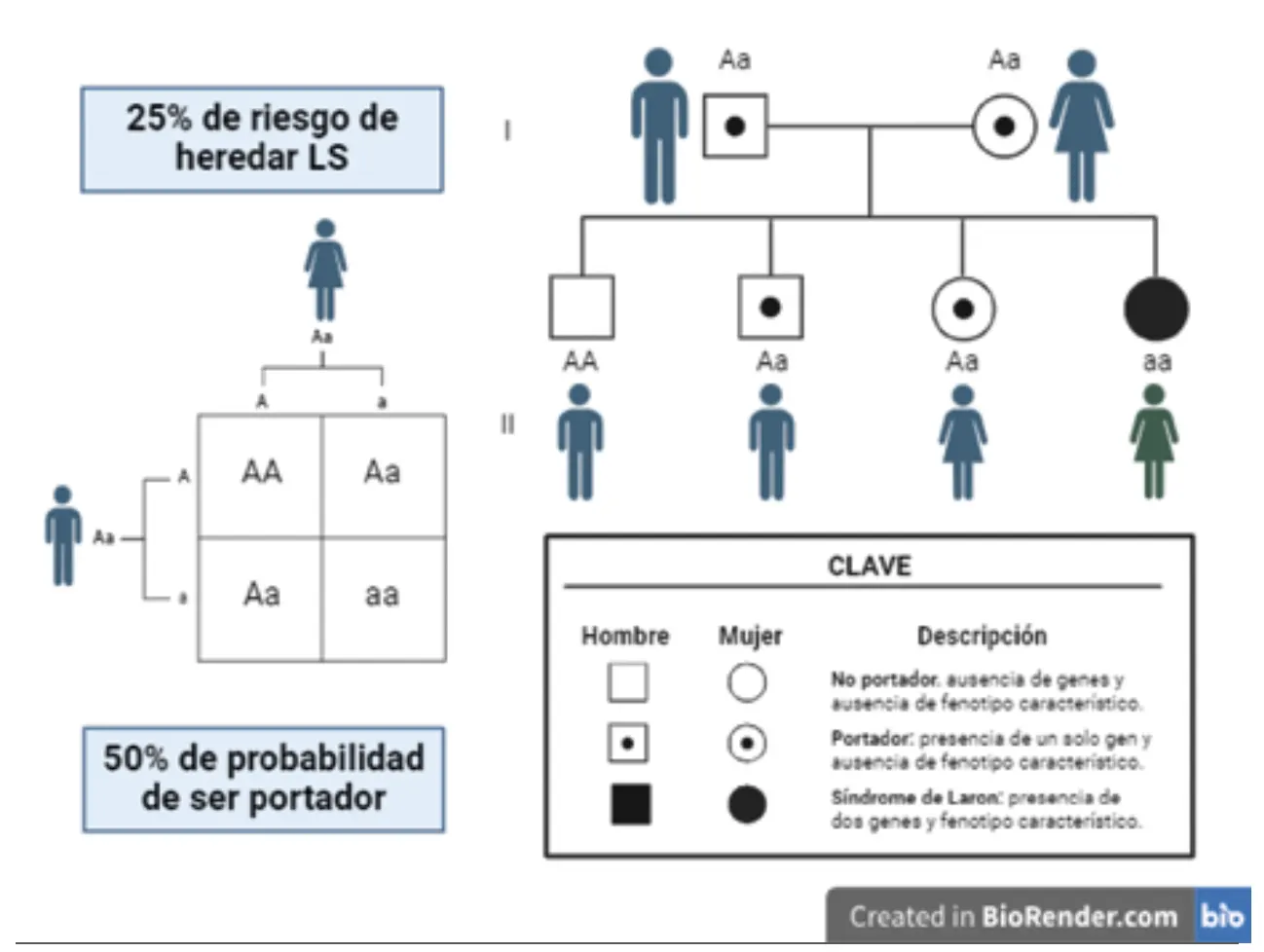
Figura 2. Árbol genealógico del LS.
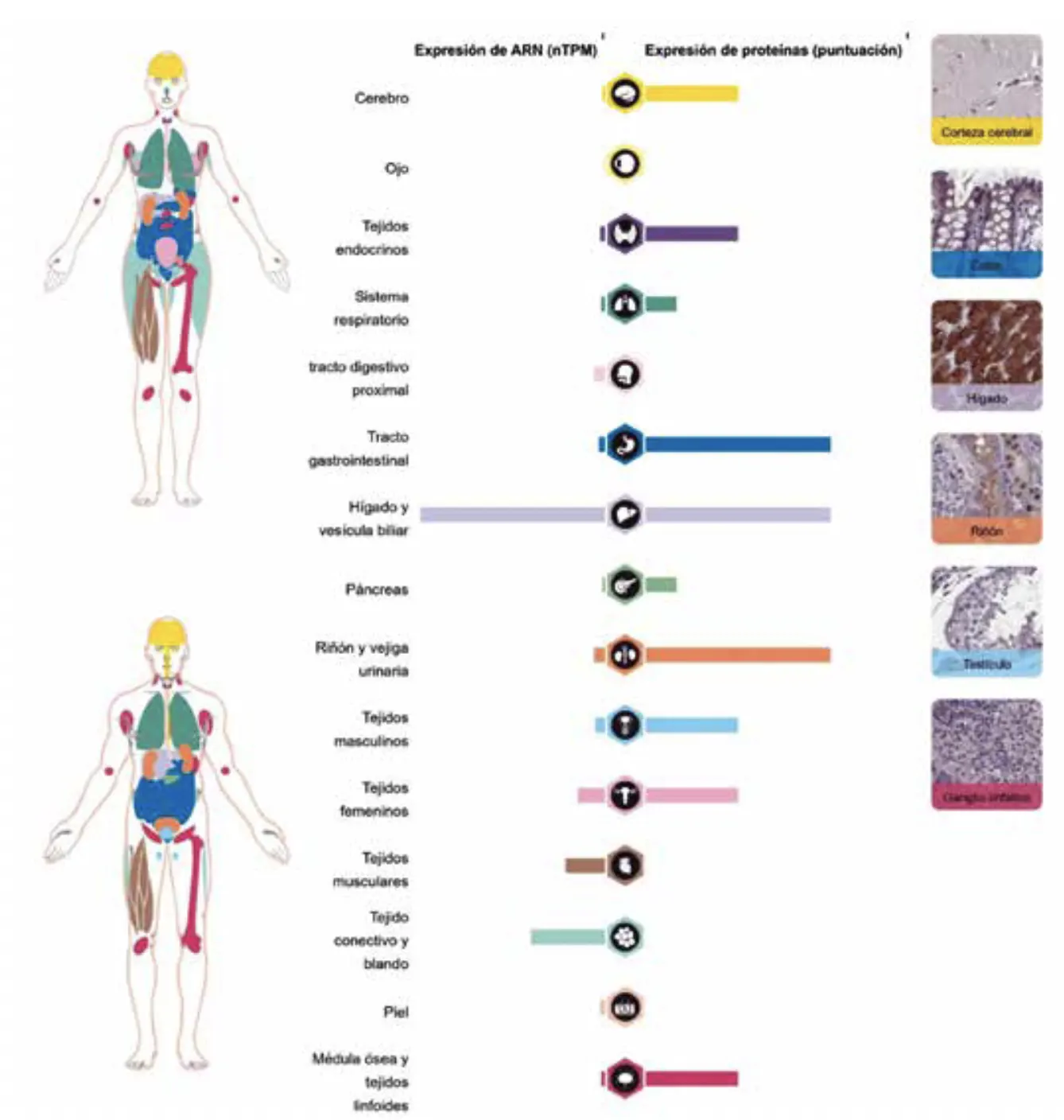
Figura 3. Expresión de GHR en diferentes tejidos, tomado de la página de The Human Protein Atlas. GHR INFORMATION (11).
Protección contra el cáncer y la diabetes mellitus
Los análisis epidemiológicos han demostrado que los pacientes con LS de la población ecuatoriana tienen una menor incidencia de cáncer y diabetes mellitus tipo 2 (DM2) (10).
La investigación de Guevara-Aguirre et al., realizada en población ecuatoriana, encontró que las concentraciones séricas reducidas de insulina, IGF-1, glucosa y triglicéridos, características de este síndrome, se relacionan a una menor incidencia de enfermedades, como el cáncer y diabetes mellitus tipo 2, gracias a la variante del GHR, que resulta en valores relativamente bajos de IGF-I e insulina.
Otro estudio realizado por Lapkina y colaboradores reveló un mayor porcentaje de grasa corporal (> 50%) junto con una relación reducida de masa magra/grasa en todos los sujetos estudiados con LS. Junto con estas características antropométricas, se encontró una disminución de la resistencia a la insulina en todas las edades, lo que significaba una protección contra la diabetes en la adolescencia y la edad adulta. En este contexto, la coexistencia paradójica de obesidad y ausencia de diabetes en los sujetos con Deficiencia del receptor de GH (GHRD) implica la presencia de un mecanismo protector (13,14).
La ausencia de cáncer en la población con LS se ha asociado a la falta de exposición al IGF-1 e hipoinsulinemia, dos agentes que juegan un rol fundamental en los factores mitogénicos y de crecimiento Los niveles disminuidos de IGF-1 conllevan a la activación de varías vías apoptóticas, autofágicas y protectoras del cáncer debido a una regulación positiva de genes proapoptóticos y a una regulación negativa de enzimas que favorecen la oncogénesis (mTOR, S6K, RAS, adenilato ciclasa y PKA), ubicadas “aguas abajo” de la vía de IGF-1. El IGF1R es un regulador fundamental en la transcripción del gen, y se ha visto una sobreexpresión en células malignas. Su unión con IGF-1 activa vías transcripcionales que permiten la expresión de genes mitogénicos, de modo que niveles disminuidos de IGF-1 conduce a un efecto importante en la prevención de cáncer.
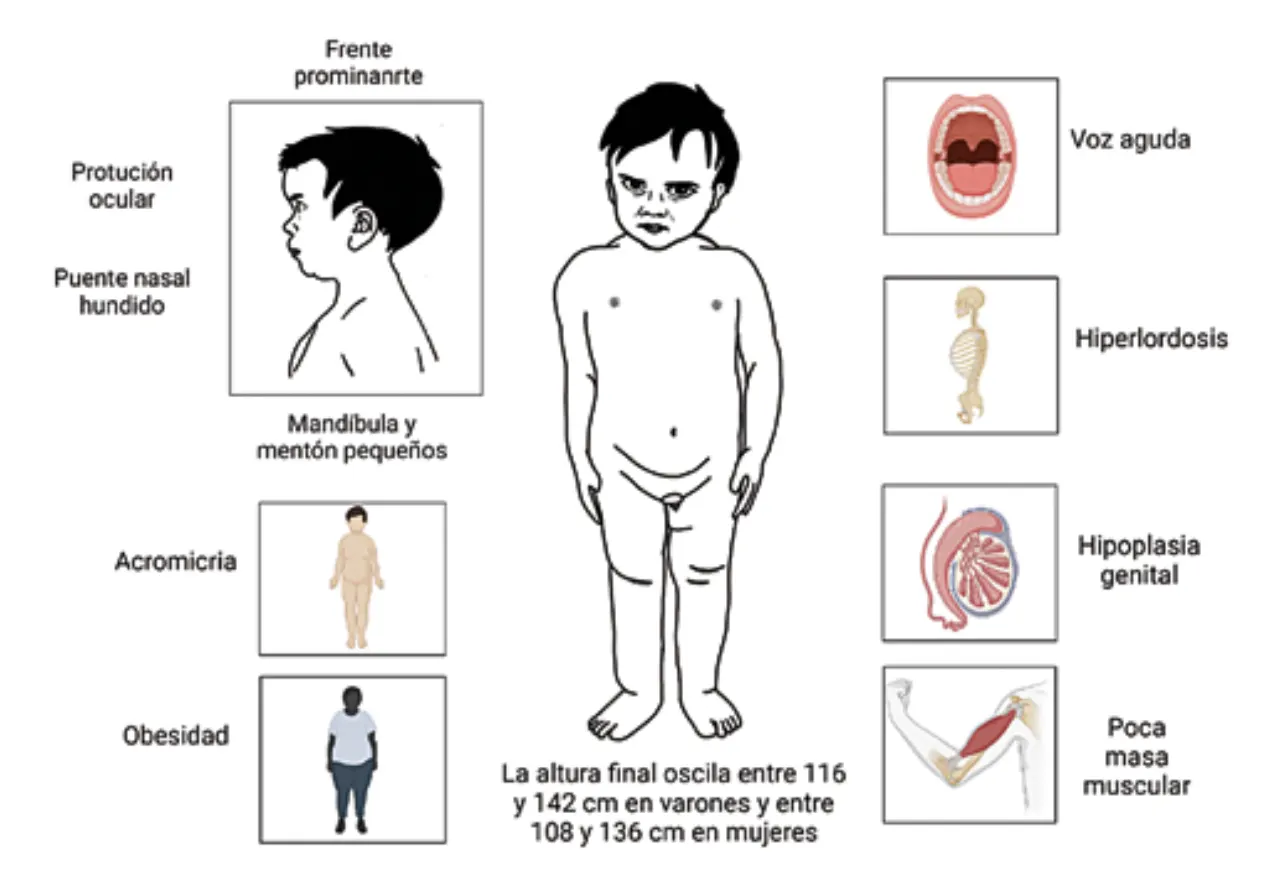
Figura 4. Características fenotípicas del LS.
Otra de las vías de señalización de interés oncológico es la de p53, donde se ha demostrado un circuito de retroalimentación entre p53 e IGF-1. Por un lado, se ha visto que p53 suprime la transcripción del gen IGF1R y evita de esta forma la expansión de poblaciones de células cancerígenas.
En cambio, el IGF-1 impulsa la degradación de p53 e incrementa el riesgo de desarrollar cáncer (13,15). Es importante destacar que niveles elevados de glucosa en sangre y la presencia de DM2 elevan el riesgo de cáncer de forma independiente.
Síntomas y diagnóstico
El embarazo y el parto suelen ser normales, el peso al nacer es adecuado para la edad gestacional o es ligeramente bajo, pero las características fenotípicas se reconocen inmediatamente
tras el nacimiento (15).
Las características fenotípicas al nacer permiten la sospecha clínica de síndrome de Laron: frente prominente, puente nasal hundido (en silla de montar), mandíbula y mentón pequeños,
cabello escaso, hipoplasia mediofacial, ojos prominentes, manos y pies pequeños y, aunque pueden presentar un peso y longitud normales, se observa un retraso del crecimiento postnatal
de moderado a grave (Figura 4) (16).
Conforme el individuo crece, es posible identificar un retraso del crecimiento posnatal de moderado a grave, que ronda entre los -4 y -10 SDS por debajo de la altura media para el sexo y la edad. Además, las secciones del cuerpo no son proporcionales, pues muestra acromicria (tamaño pequeño de las extremidades)
(Figura 4) y, de igual forma, la obesidad se evidencia
Figura 4. Características fenotípicas del LS. desde el momento de nacimiento, la que suele acompañarse de hiperlipidemia (17).
Otros rasgos característicos son voz aguda-chillona-, retraso en la erupción dental, protrusión ocular, hiperlordosis, hipoplasia genital y retraso en la pubertad; suelen presentar los dientes apiñados, que generalmente pueden romperse debido a las caries frecuentes (Figura 4) (4).
La condición genética debe sospecharse en presencia de antecedentes familiares de LS y relaciones de consanguinidad (4). En relación con ello, Savage et al. propuso 7 criterios diagnósticos para el síndrome de Laron, los cuales se basan principalmente en medir los niveles de GH, IGF-1, IGFBP-3 y valorar la curva de crecimiento (Tabla 1), de tal manera que el diagnóstico se realiza si 5 de los 7 parámetros son positivos (18). Por otro lado, para el diagnóstico definitivo molecular sería necesario la implementación de la identificación de las variantes en el gen GHR.

Tabla 1. Criterios diagnósticos del síndrome de Laron
1 SDS: Puntaje de desviación estándar.2 GH: Hormona de Crecimiento. 3 IGF-1: Factor de Crecimiento Similar a la Insulina 1. 4 IGFBP-3: Proteína de Unión al Factor de Crecimiento Similar a la Insulina 3. *Se refiere al porcentaje de GH unida a receptor
Las concentraciones séricas de IGF-1 son muy bajas, a menudo indetectables y no aumentan con la administración de GH humana exógena (prueba de generación de IGF-1. En el artículo publicado por Boro, H et al., la prueba de generación de IGF- 1 se realizó mediante la administración de hormona de crecimiento humana (GH) recombinante a una dosis de 33 μg/kg/día durante cuatro días consecutivos (18). El IGF-1 sérico se midió al inicio y 12 horas después de la última dosis de inyección de GH; así pues, un incremento en IGF-1 de <15 μg/L se consideró una prueba fallida sugestiva de resistencia a la GH.
Tratamiento
El IGF-1 es el principal mediador hormonal de crecimiento; en los tejidos diana, activa la cascada de señalización intracelular que estimulará varios procesos metabólicos (19), con lo que el tratamiento empleado para este síndrome es la IGF-1 recombinante o la mecasermina, un análogo del IGF-1 (Increlex® en su nombre comercial), actualmente considerado el único fármaco que existe para tratar el tratamiento del LS (20).
Inicialmente, el tratamiento se suministra según las necesidades y condiciones de cada paciente, pero se establece como dosis inicial de 0,04 mg por peso corporal, dos veces al día, pudiéndose modificar la dosis si se requiere (19). Se dosifica hasta un máximo de 0,12 mg/kg y se opta por una dosis mínima de 0,04 mg/kg para pacientes que no toleran la dosis inicial (20). La vía de administración es subcutánea y el efecto adverso más conocido es la hipoglucemia y la hipertensión endocraneal (20,21).
La mecasermina (Increlex®) es eficaz para el crecimiento de los pacientes, que llegan a ganar en promedio 7,6 centímetros de estatura en el primer año de tratamiento y, al final del mismo, puede haber una ganancia aproximadamente de 13 centímetros (17,21). El tratamiento se instaura desde los dos años hasta los dieciocho años o hasta el cierre de las epífisis (13), por lo que el cierre del cartílago de osificación es la principal limitante para la administración del tratamiento.
Conclusiones
El síndrome de Laron es una condición genética que se caracteriza por variantes en el gen del GHR, que conduce a niveles bajos o ausencia de la IGF-1, que, a su vez, conlleva a una concentración sérica de GH elevada. Las personas con deficiencia de este receptor presentan características fenotípicas distinguibles de otras enfermedades endocrinológicas, donde destaca su baja estatura, rasgos faciales, hipoglicemias, longevidad aumentada y una menor incidencia de cáncer. Actualmente, la literatura describe la variante con mayor relevancia clínica más común para el receptor, la misma que se ha descrito en pacientes ecuatorianos. Por otro lado, la deficiencia permanente de IGF-1 en LS podría activar vías de protección contra el cáncer a nivel del organismo, incluidos los mecanismos apoptóticos y autofágicos. Esto significa que, al extraer datos genómicos y epigenómicos de pacientes con LS, se podría generar nueva información clínica, que eventualmente se traducirá en nuevas vías de investigación en las áreas del envejecimiento, el metabolismo y la oncología.
Financiamiento
Agradecemos a la Universidad Técnica Particular de Loja por su financiamiento para el desarrollo de esta investigación mediante el proyecto número PY3898.
Conflictos de interés
Los autores declaran que no existe conflicto de intereses.
Referencias
1. Cooke DW, Divall SA, Radovick S. Crecimiento normal y alterado en los niños. In: Williams Tratado de endocrinología. 2021.
2. Boguszewski CL, Boguszewski MC da S, de Herder WW. From dwarves to giants: South American’s contribution to the history of growth hormone and related disorders. Vol. 50, Growth Hormone and IGF Research. 2020.
3. Audí L, Bueno M, Calzada R, Cassorla F, Diéguez C, Ferrández A, et al. Tratado de Endocrinología Pediátrica 4a Edición. Vol. 4ta edicio, McGraw-Hill Interamericana de España. 2020.
4. Ramírez López LR, Vinueza López DE, Jácome Sánchez MF, Viteri Rodríguez JA, Ramírez López LR, Vinueza López DE, et al. Enanismo tipo Laron, el síndrome con incidencia disminuida en diabetes y cáncer: revisión bibliográfica. Revista Universidad y Sociedad. 2021;13(6).
5. Mastromauro C, Giannini C, Chiarelli F. Short stature related to Growth Hormone Insensitivity (GHI) in childhood. Vol. 14, Frontiers in Endocrinology. 2023.
6. Caputo M, Pigni S, Agosti E, Daffara T, Ferrero A, Filigheddu N, et al. Regulation of gh and gh signaling by nutrients. Vol. 10, Cells. 2021.
7. Murray PG, Clayton PE. Disorders of Growth Hormone in Childhood. Endotext. 2000.
8. OMIM. GROWTH HORMONE RECEPTOR; GHR [Internet]. 2014 [cited 2023 Dec 9]. Available from: https://www.omim.org/entry/600946#biochemicalFeatures
9. HGNC. Gene symbol report | HUGO Gene Nomenclature Committee. Symbol report for GHR HGNC data for GHR. 2023.
10. National Library of Medicine. 600946[MIM] [Internet]. 2023 [cited 2023 Dec 9]. Available from: https://www.ncbi.nlm.nih.gov/clinvar?term=600946[MIM]
11. The Human Protein Atlas. GHR INFORMATION [Internet]. 2014. Available from: https://www.proteinatlas.org/ENSG00000112964-GHR
12. Villela TR, Freire BL, Braga NTP, Arantes RR, Funari MFA, Jorge AAL, et al. Growth hormone insensitivity (Laron syndrome): Report of a new family and review of Brazilian patients. Genet Mol Biol. 2019;42(4).
13. Werner H, Sarfstein R, Nagaraj K, Laron Z. Laron Syndrome Research Paves the Way for New Insights in Oncological Investigation. Vol. 9, Cells. 2020.
14. Guevara-Aguirre J, Peña G, Acosta W, Pazmiño G, Saavedra J, Soto L, et al. Cancer in growth hormone excess and growth hormone deficit. Endocr Relat Cancer. 2023;30(10).
15. Guevara-Aguirre J, Bautista C, Torres C, Peña G, Guevara C, Palacios C, et al. Insights from the clinical phenotype of subjects with Laron syndrome in Ecuador. Vol. 22, Reviews in Endocrine and Metabolic Disorders. 2021.
16. Rajalakshmi SL, Gunasekaran S, Prasad HK, Gowrishankar K, Narayanasamy K, Krishnamoorthy N. Laron syndrome in South Indian children – A descriptive study. Journal of Pediatric Endocrinology and Diabetes. 2023;2.
17. Laron Z, Werner H. Laron syndrome – A historical perspective. Vol. 22, Reviews in Endocrine and Metabolic Disorders. 2021.
18. Boro H, Rahman SH, Khatiwada S, Alam S, Khadgawat R. Laron syndrome: An experience of treatment of two cases. J Clin Transl Endocrinol Case Rep. 2021;19.
19. Rosenbloom AL, Guevara-Aguirre J, Rosenfeld RG, Francke U. Growth hormone receptor deficiency in Ecuador. Vol. 84, Journal of Clinical Endocrinology and Metabolism. 1999.
20. Cabrera AJO, Portilla CCR, Caraguay SAV, Di Rosa RR, Bravo MPC. Síndrome de Laron: aspectos clínicos y pronóstico en pacientes tratados con mecasermina. Brazilian Journal of Health Review. 2023;6(1).
21. Werner H, Laron Z. Insulin-like growth factors and aging: lessons from Laron syndrome. Vol.14, Frontiers in Endocrinology. 2023.
