INVESTIGACIÓN ORIGINAL
Análisis de supervivencia global a cinco años en pacientes con cáncer gástrico atendidos en la provincia de Loja-Ecuador
Analysis of overall 5-year survival in patients with gastric cancer treated in the province of Loja-Ecuador
Pablo R. Aldaz-Roldán 1 2 A; Xavier Astudillo-Romero 1 B; Alexis Manrique G. 1 C; Grace Cambizaca 1 D; Diana Marín E; Daniel Aldaz-Correa 4 F, María Chiriboga 1 G; Miriam Encalada 1 H
1. Universidad Técnica Particular de Loja, Facultad de Ciencias de la Salud, Loja, Ecuador
2. Hospital de la Sociedad de Lucha contra el Cáncer (SOLCA) Núcleo de Loja, Ecuador, Departamento de Radioterapia y Medicina Nuclear
3. Universidad Pontificia Bolivariana, Medellín, Colombia
4. Universidad Nacional de Loja, Facultad de Medicina, Loja, Ecuador
Palabras Clave: Cáncer gástrico, análisis de supervivencia, mortalidad
Keywords: Stomach Neoplasms, Survival analysis, Mortality
Fecha recepción: 18-05-2024
Fecha aceptación: 10-07-2024
Fecha publicación: 01-08-2024
Resumen
Introducción: El cáncer gástrico es uno de los que presentan mayor mortalidad a nivel mundial. La supervivencia del adenocarcinoma gástrico a cinco años fluctúa entre el 5-15% y depende principalmente del estadio al diagnóstico. Objetivos: Identificar los factores asociados con la supervivencia global a cinco años en los pacientes con cáncer gástrico en la población estudiada. Metodología: Estudio con diseño de cohorte de pacientes diagnosticados con cáncer gástrico en el Hospital Sociedad de Lucha Contra el Cáncer Núcleo de Loja-Ecuador, de julio de 2009 a diciembre de 2014, y con seguimiento hasta diciembre de 2019. Se estimó la supervivencia con el método actuarial y con el método de Kaplan-Meier y se utilizó una regresión de Cox para estimar los Hazard ratio ajustados. Resultados: Se estudiaron 131 pacientes. La mediana supervivencia global fue 0,85 años (intervalo de confianza 95%: 0,70-0,98) y el 15% de los pacientes sobrevivió a los 5 años. Los principales predictores de peor supervivencia fueron edades menores a 40 años, estadio clínico IV (hazard ratio = 4,57 intervalo de confianza 95%: 1,50-19,92); pacientes sin gastrectomía (hazard ratio = 11,20 intervalo de confianza 95%: 4,67-28,85); y grado histológico pobremente diferenciado (hazard ratio = 3,12 intervalo de confianza 95%: 1,26 -7,79). Conclusiones: Una mayor supervivencia se asocia con el tratamiento quirúrgico relacionado con estadios tempranos y un diagnóstico histopatológico de tumores bien diferenciados.
Abstract
Introduction: Stomach cancer is one of the cancers with the highest mortality worldwide. The 5-year survival of gastric adenocarcinoma fluctuates between 5-15% and depends mainly on the stage at diagnosis. Objectives: To identify the factors associated with overall 5-year survival in patients with gastric neoplasm in the studied population. Methodology: Study with a cohort design of patients diagnosed with gastric cancer at the “Sociedad de Lucha Contra el Cáncer, Núcleo de Loja-Ecuador Hospital”, from July 2009 to December 2014 and with follow-up until December 2019. Survival was estimated with the actuarial method and with the Kaplan-Meier method and Cox regression was used to estimate adjusted hazard ratios. Results: 131 patients were studied. Median overall survival was 0.85 years (95% confidence interval 0.70-0.98) and 15% of patients survived 5 years. The main predictors of worse survival were ages under 40 years, clinical stage IV (hazard ratio = 4.57 95% confidence interval = 1.50 – 19.92); patients without gastrectomy (hazard ratio = 11.20 95% confidence interval = 4.67 – 28.85); and poorly differentiated histological grade (hazard ratio = 3.12 95% confidence interval = 1.26 – 7.79). Conclusions: A more prolonged survival is associated with surgical treatment related to early stages and a histopathological diagnosis of well-differentiated tumors.
Ideas clave
Según el registro nacional de tumores en Ecuador, el cáncer gástrico (CG) en Loja presenta una tasa de 25,7 hombres y 20 mujeres por cada 100 000 habitantes.
El estudio concluyó que los estadios tempranos de enfermedad, grados bien o moderadamente diferenciados de células tumorales, la realización de gastrectomía total o subtotal como parte del tratamiento, y una edad mayor a 40 años son factores que influyen positivamente en la supervivencia.
Se trata del primer análisis de supervivencia que permite conocer los factores asociados a una mayor supervivencia de los pacientes con CG, atendidos en la región.
Introducción
El CG es la segunda neoplasia gastrointestinal más frecuente en todo el mundo y ocupa el sexto lugar de mortalidad por cáncer a nivel global [1). La incidencia de CG es más frecuente en el este de Asia, Europa del Este, América Central y América del Sur, y se conoce que el 30% de casos se diagnosticaron en etapas tempranas (etapa IA) y el 70% en etapas avanzadas [2,3). Estudios retrospectivos realizados en Latinoamérica reportan que el 80,2% de los pacientes con esta neoplasia se diagnostican en etapas clínicas III y IV, con una supervivencia a cinco años del 4 al 30%, dependiendo del país [4). En Ecuador, las tasas son altas según el registro de tumores de SOLCA Quito; para el periodo 2011-2015, se presentaron incidencias de 19,6 por 100 000 hombres y de 13,9 por 100 000 mujeres (5).
El tratamiento de esta patología se basa en la combinación de cirugía, quimioterapia y radioterapia, y la decisión de cuál utilizar depende del estadio clínico de la enfermedad. El tratamiento quirúrgico es hasta el momento el único procedimiento que tiene un potencial curativo, mientras que la ausencia de metástasis ganglionares, tamaño del tumor, histología y profundidad de invasión actúan como factores pronósticos independientes en análisis multivariados (6–9).
La gastrectomía total es bien conocida como un procedimiento complejo que conlleva un riesgo significativo de morbilidad y mortalidad postoperatoria, sobre todo en pacientes mayores de 70 años (10). La resección quirúrgica es factible en 60 a 80% y la mortalidad postoperatoria varía entre 6% y 14%. La tasa de supervivencia a 5 años oscila entre el 8 y el 26% en general (9,11,12), sin embargo, en algunos países, esta supervivencia asciende al 52% en algunas series de pacientes, debido a los programas de detección precoz del cáncer o tratamientos en estadios tempranos (13,14). Es importante señalar que la mortalidad es menor en los pacientes sometidos a resecciones radicales en comparación con cirugías con carácter paliativo (10). Al comparar los tipos de cirugía, se reportan resultados similares en cuanto a morbilidad, mortalidad general y supervivencia global; pese a ello, se recomienda realizar gastrectomía subtotal si esta permite una resección completa del tumor (15).
Otro factor que influye para la menor supervivencia es el bajo peso antes del diagnóstico por el efecto de masa producido por el tumor; a esto se añade la poca tolerancia al tratamiento quirúrgico y quimioterapia posterior y el incremento en la toxicidad y efectos secundarios más intensos debidos a déficits nutricionales (16). La edad al diagnóstico puede influir en la morbilidad y mortalidad, considerando que los pacientes mayores sometidos a procedimientos quirúrgicos se complican más frecuentemente por sus comorbilidades, en comparación con los pacientes más jóvenes (10).
Adicionalmente, en pacientes jóvenes menores de 50 años, en algunos estudios, se ha reconocido una mayor frecuencia de tumores más agresivos, como los de patrón de crecimiento difuso (17,18), lo cual implica peores características clínicas y patológicas, que reflejan un pronóstico desfavorable para la supervivencia en comparación con pacientes de mayor edad (19). Así se determinó en un estudio que reportó que los tumores de tipo difuso presentaron peor pronóstico que los de tipo intestinal (p= 0,013), y el análisis multivariado reveló que el estadio T, estadio N, tamaño del tumor y clasificación de Lauren difuso eran factores independientes de peor pronóstico; igualmente se corroboró que los CG de tipo difuso se asociaron significativamente con pacientes jóvenes de sexo femenino, localizaciones distales y clasificación TNM más avanzado (20).
Asimismo, está demostrada la fuerte relación del Helicobacter pylori en la génesis del CG (21), sin embargo, las investigaciones no han demostrado estadísticamente la influencia del H. pylori en la supervivencia luego de que el CG está establecido (22).
En otro orden de ideas, para el 2020, la incidencia de CG en Ecuador fue del 12,5 por 100 000 habitantes (23), la incidencia en Loja fue en hombres (27,7) y en mujeres (21,1) hasta el 2014 (5), y alcanzaron cifras tan elevadas como la mayor incidencia en el mundo (22,4 en el este de Asia) (23). Además de eso, no se han analizado los datos que rutinariamente se vienen recolectando en el Registro de Tumores SOLCA Núcleo de Loja desde 1997, que sigue los estándares de calidad establecidos por la Agencia Internacional para la Investigación del Cáncer (IARC). Es por ello que se decidió realizar una investigación retrospectiva para identificar los factores asociados con la supervivencia global a cinco años en los pacientes con diagnóstico de CG, en la cual se planteó la hipótesis de que los factores que afectan negativamente a la supervivencia son estadios clínicos avanzados, presencia de histologías poco diferenciadas, presencia de H. pylori, dificultades para realización de gastrectomías curativas, bajo peso y edades avanzadas.
Materiales y Métodos
Diseño
Se trata de una investigación que utilizó un diseño de cohorte con todos los pacientes diagnosticados con CG en el hospital SOLCA Núcleo de Loja-Ecuador, de julio de 2009 a diciembre de 2014, y con seguimiento hasta diciembre de 2019 para determinar la supervivencia global a cinco años.
Contexto
El estudio se desarrolló en el Hospital de la Sociedad de Lucha contra el Cáncer, (SOLCA Núcleo de Loja), que es la unidad de referencia de pacientes para diagnóstico, tratamiento y seguimiento oncológico al sur del Ecuador. Este centro cuenta con un área en la cual se recopilan los datos de todos los pacientes con diagnóstico histológico de cáncer, conocido como Registro de Tumores SOLCA Núcleo de Loja, que abarca la provincia ubicada al sur de Ecuador, la cual cubre aproximadamente el 2,56% de la población ecuatoriana. Este registro capacita continuamente al personal para la recopilación de los datos de los pacientes de acuerdo con las recomendaciones de la Agencia Internacional para la Investigación del Cáncer.
Los esquemas de diagnóstico y tratamiento cumplen los lineamientos de la National Comprehensive Cancer Network. El seguimiento de todos los pacientes, una vez finalizado su tratamiento oncológico, se realiza trimestralmente durante el primer año y semestralmente hasta completar los cinco años de control, o hasta que el paciente lo requiera, con el fin de establecer si hubo curación completa, progresión o recaída de la enfermedad, en cuyo caso posteriormente se continúa con otra fase del tratamiento si así se requiere, según lo estipulado en la misma guía.
Población y muestra
El universo estuvo constituido por 478 pacientes diagnosticados con cáncer de estómago, estadio I-IV, en el hospital SOLCA Núcleo de Loja-Ecuador, entre el 01 de junio de 2009 y el 31 de diciembre de 2014. Para la muestra se incluyó a todos los pacientes que contaron con estudio histopatológico, endoscopia y estudios imagenológicos, como tomografía o resonancia magnética, para su estadificación. De un total de 478 pacientes con diagnóstico de CG de cualquier denominación, se excluyeron 347 pacientes por incumplimiento en los criterios de elegibilidad (figura 1). La muestra final quedó conformada por 131 pacientes y ninguno se perdió durante el estudio.
Figura 1. Flujograma de selección de pacientes para el estudio
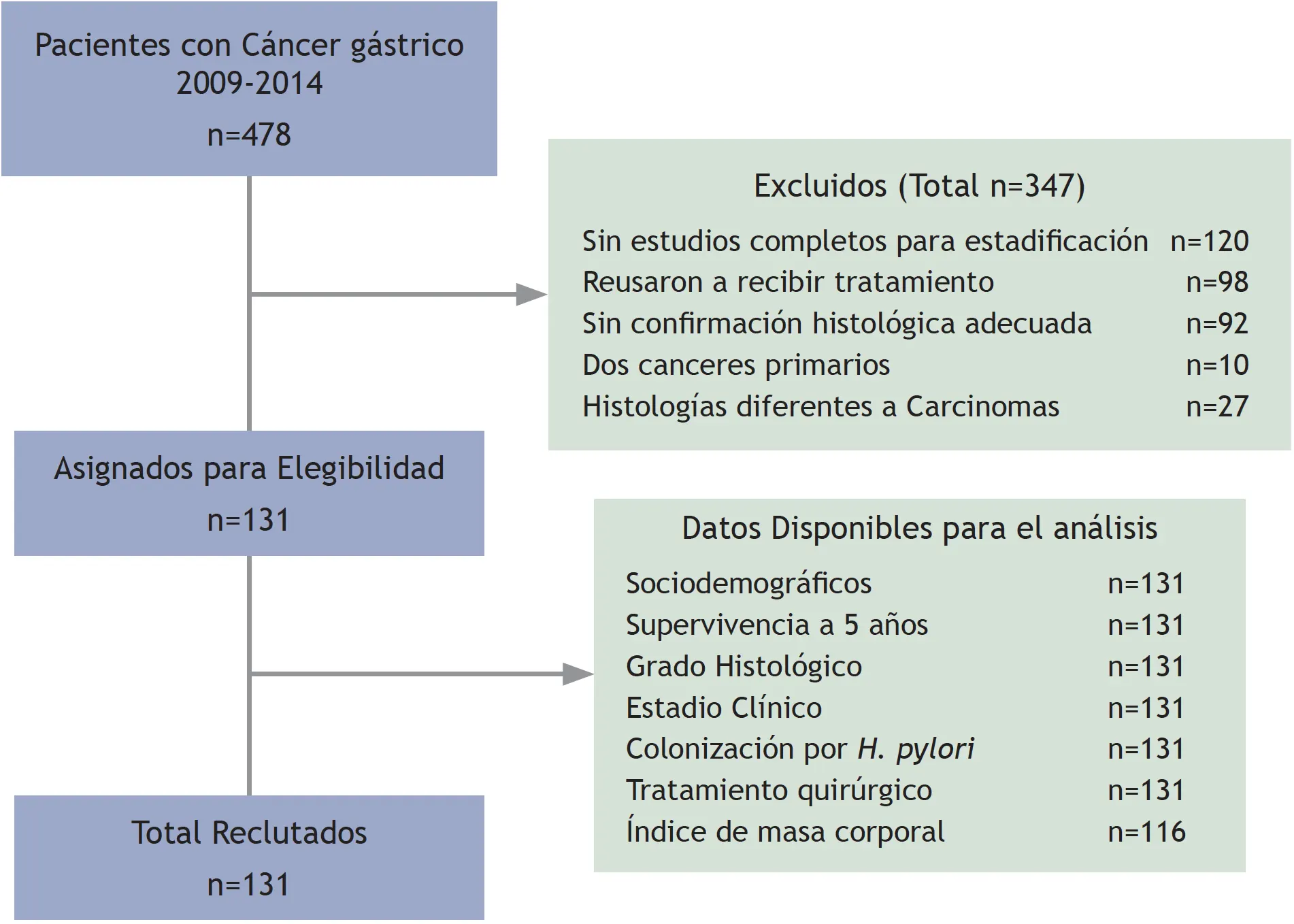
Fuente: preparado por los autores a partir de los resultados del estudio.
Fuente de datos
La información se obtuvo de la base de datos del Registro de Tumores SOLCA Núcleo de Loja, que es un inventario de base poblacional que toma casos, de forma programática, de todos los pacientes con diagnóstico de cáncer de la provincia de Loja, desde 1997. Este registro recopila y depura la información para que la base contenga información de instituciones públicas y privadas, de todas las muestras de biopsia o piezas quirúrgicas con confirmación histopatológica de cáncer, dentro y fuera de la provincia, identificando al paciente, determinando la fecha de diagnóstico. Más adelante, se somete a una revisión minuciosa de los exámenes de estadificación (endoscopia digestiva alta, tomografía o resonancia magnética corporal) para la respectiva confirmación y clasificación de los pacientes según su estadio clínico dado por médicos especialistas.
Esta base de datos está actualizada hasta el año 2015, con información sociodemográfica y clínica de los pacientes al momento de la investigación. El acceso a la información se da con el permiso previo de la Presidencia Ejecutiva de SOLCA Loja, siempre que se use para fines de investigación o publicación.
Variables
La variables consideradas para el análisis fueron los siguientes: edad en años (en cuatro grupos: ≤40; 41–60; 61–80, y >81), sexo, tipo de intervención quirúrgica (gastrectomía total, gastrectomía subtotal o no gastrectomía), presencia de infección por H. pylori (positivo, negativo), grado de diferenciación histológica (bien diferenciado, moderadamente diferenciado, pobremente diferenciado y anaplásico/anillo de sello); índice de masa corporal (bajo peso – IMC<18,5; peso normal – 18,5 a 24,9; sobrepeso/obesidad >25), estadio clínico I – IV determinado considerando el TNM (tamaño de tumor, ganglios y metástasis) de la American Joint Committee on Cancer, séptima edición.
Para establecer la supervivencia a los cinco años, se determinó como fecha inicial el diagnóstico establecido según el primer informe histopatológico del paciente. Se definió como fecha final, la fecha de la muerte, considerado como el evento a estudiar para el análisis de sobrevida, el cual se estableció de acuerdo con el registro de tumores, y se hizo un chequeo de todos los pacientes conforme al certificado de defunción proporcionado por el Registro Civil de Ecuador.
Análisis estadístico
Para describir la población, se utilizaron frecuencias y porcentajes para las variables cualitativas, y mediana y rango intercuartílico para las variables cuantitativas.
El cálculo de la supervivencia en cada uno de los cinco años, se estableció mediante el método actuarial por cada variable de estudio. Para comparar el tiempo de supervivencia entre grupos, se estimaron medianas y curvas de supervivencia de Kaplan-Meier, considerando las variables sexo, estadio clínico, grado de diferenciación, infección por H. pylori y grupos etarios (<40; 41-60; 61-80; >80). Las diferencias estadísticas de la supervivencia según variables se establecieron utilizando el estadístico Log Rank; se consideró como significativo un valor-p bilateral <0,05.
Para el análisis multivariado, se utilizó el modelo de los riesgos proporcionales o regresión de Cox, y se estableció el Hazard Ratio con sus respectivos intervalos de confianza. El análisis de los datos se realizó aplicando el paquete SPSS versión 24.
Resultados
La mediana de edad de los pacientes estudiados fue de 60 años (RIQ 56-76), con predominio del sexo masculino (59,5%). En las características clínicas de los pacientes a su ingreso, se destacó que el 56,9% de ellos tenían peso normal, el 45,8% estaban en estadio IV, el 45% presentó un diagnóstico histopatológico anaplásico/anillo de sello, y el 90,1% fueron negativos para infección por H. Pylori (tabla 1).
Tabla 1. Caracterización de los pacientes con CG
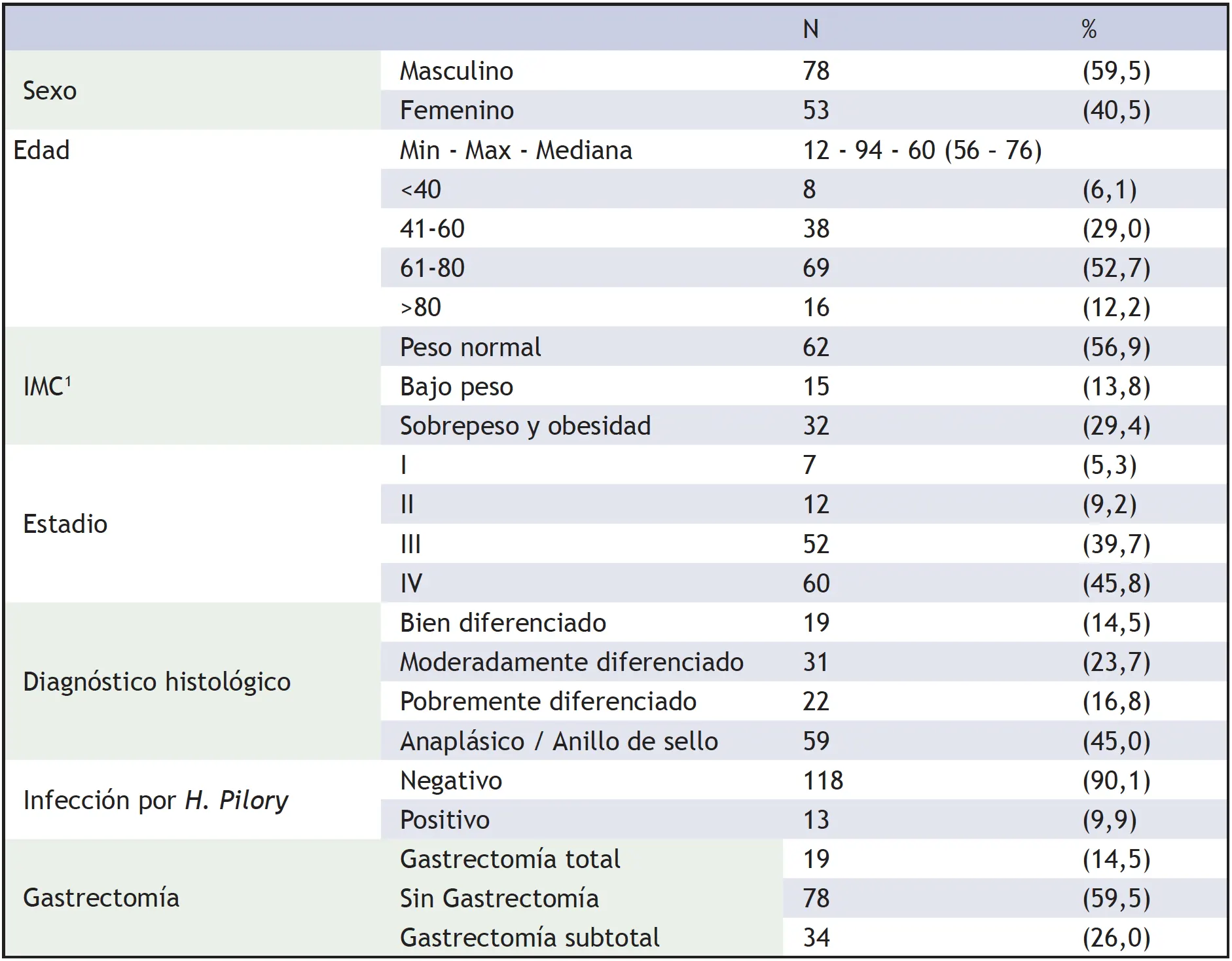
1IMC: Índice de masa corporal
El análisis actuarial para la supervivencia por años demostró que, en el primer año, la supervivencia fue del 42% y en el cuarto año, alcanzó a ser del 15%. Según los resultados obtenidos en la población estudiada, la supervivencia fue superior en hombres, en aquellos entre 61 y 80 años, con sobrepeso u obesidad, estadio clínico I, pacientes con tumores bien diferenciados, con infección por H. pilory y con un abordaje quirúrgico de gastrectomía subtotal (tabla 2).
Tabla 2. Porcentaje acumulado de supervivencia al final de cada año en pacientes con CG
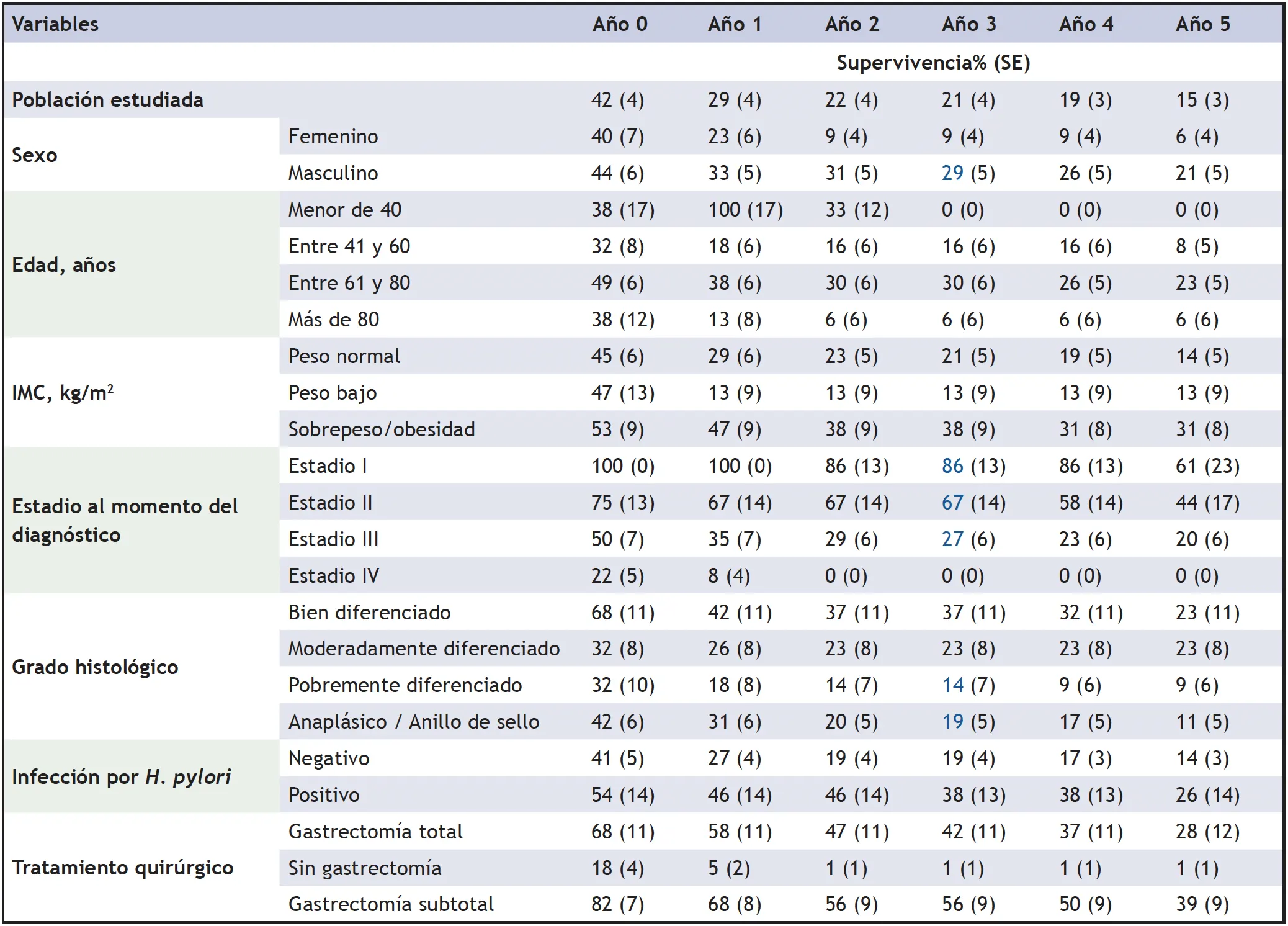
SE: Error estándar
Según el análisis bivariado, se encontró una menor supervivencia en los pacientes con estadio IV (Me = 0,50 intervalo de confianza 95%: 0.36 – 0,63) y sin tratamiento quirúrgico (Me = 0,51 intervalo de confianza 95%: 0.39 – 0,63). El resto de las variables no mostraron resultados estadísticamente significativos en sus medianas de supervivencia (tabla 3).
Tabla 3. Medianas de supervivencia en años para la población de estudio
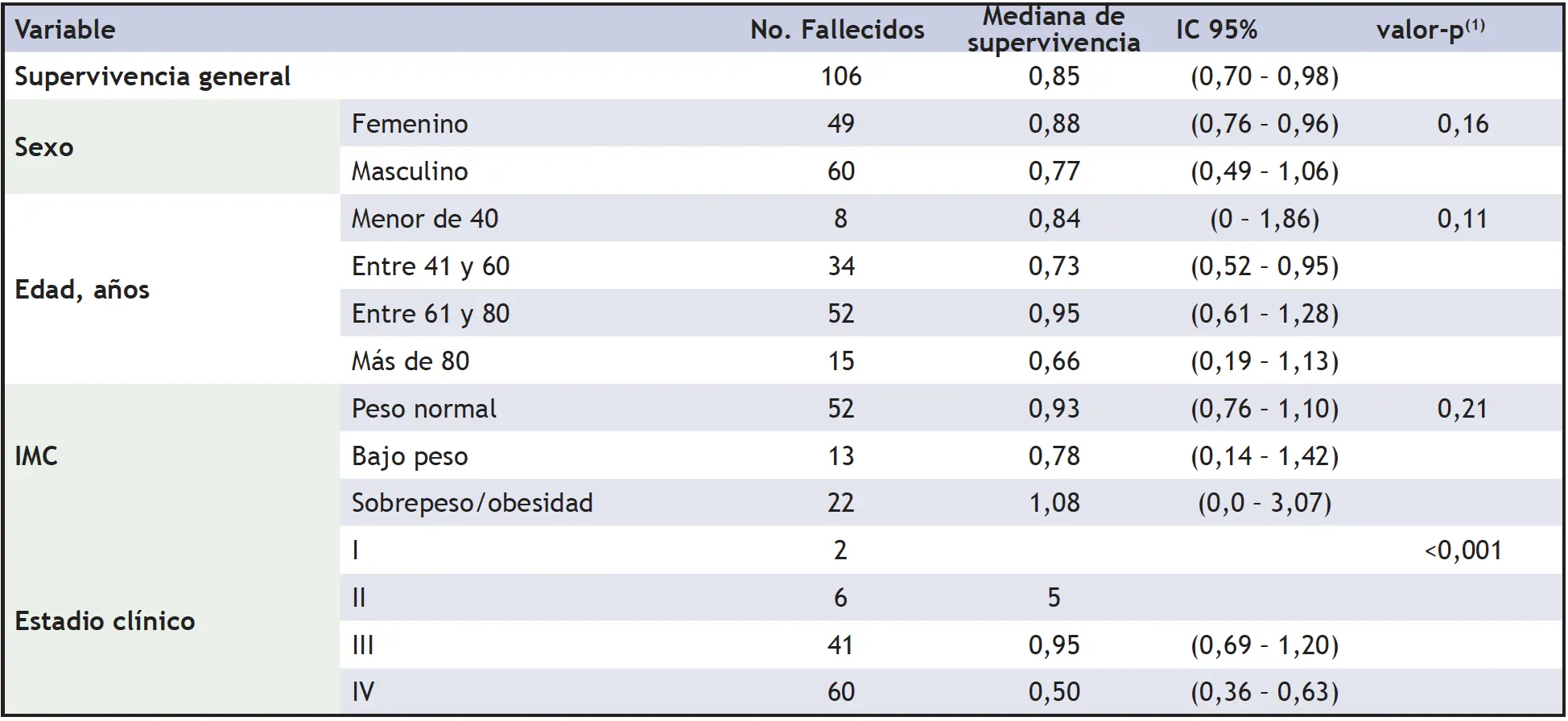
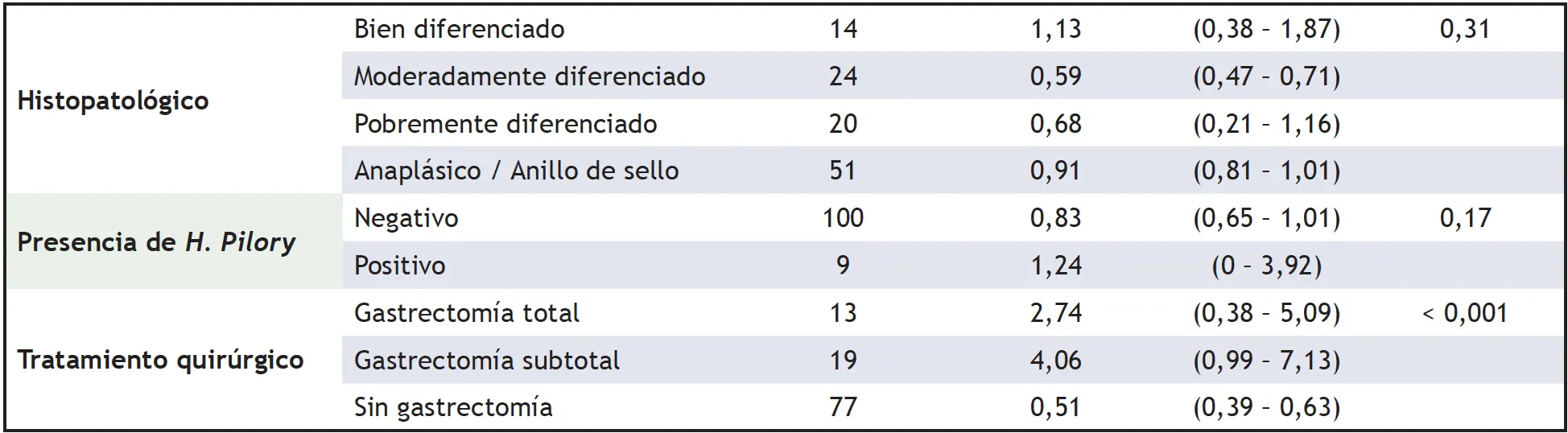
IC = Intervalo de confianza (1) Log rank test
En el modelo de regresión de Cox, los estadios III y IV tienen un HR significativamente mayor que los estadios I y II, este comportamiento es similar para los pacientes sin gastrectomía, un diagnóstico histológico moderada y pobremente diferenciados. La edad se comportó como un factor de protección (tabla 4), ya que, en los pacientes con menos de 40 años, el riesgo de morir fue mayor que en los otros grupos poblacionales.
Tabla 4. Riesgos proporcionales asociados a la supervivencia de los pacientes con CG
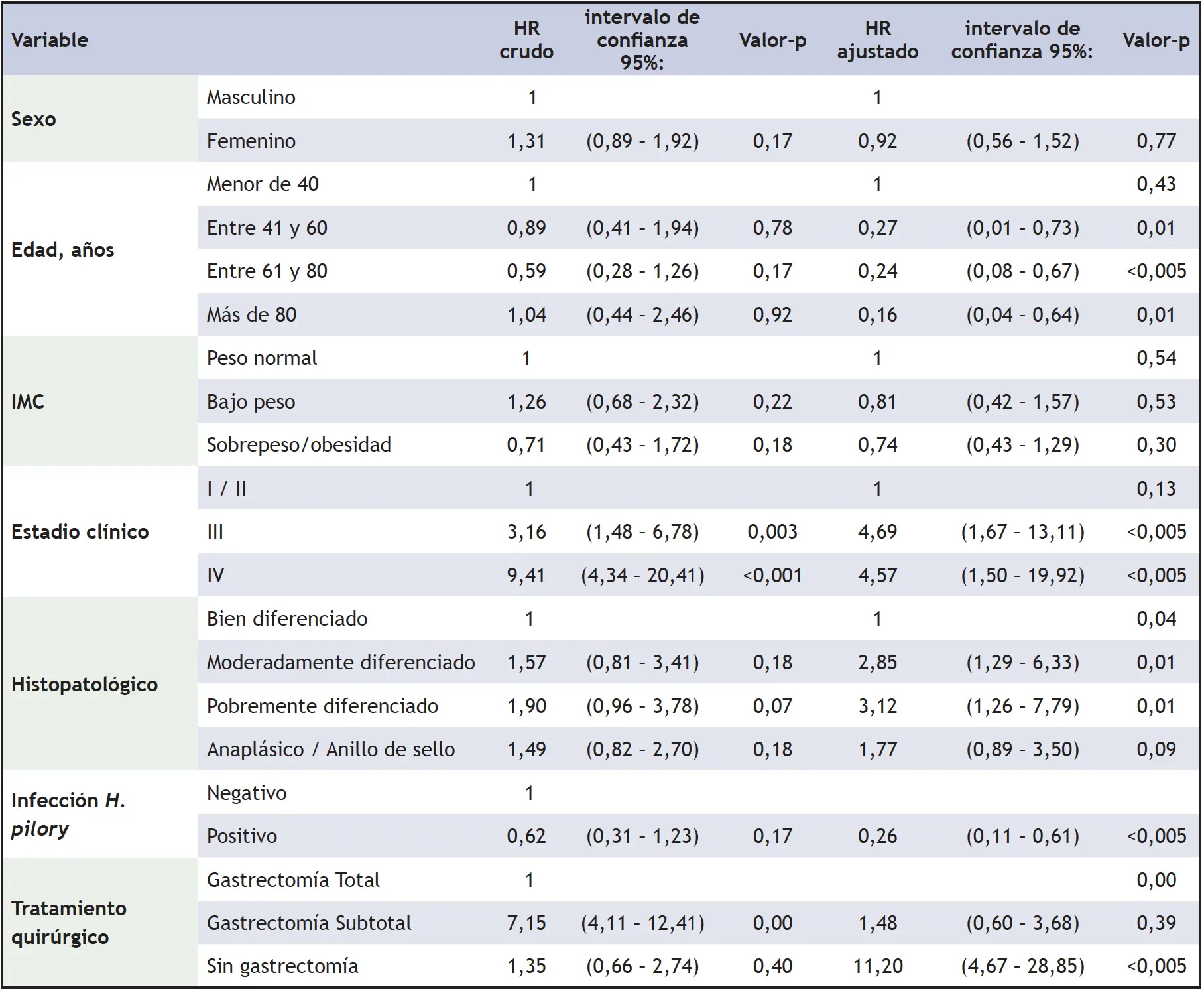
La supervivencia a los cinco años, ajustada por todos los factores evaluados, fue mayor en los pacientes en estadio I/II; además, aquellos con un diagnóstico histopatológico bien diferenciado y también quienes fueron tratados quirúrgicamente (figura 2 A-G).
A
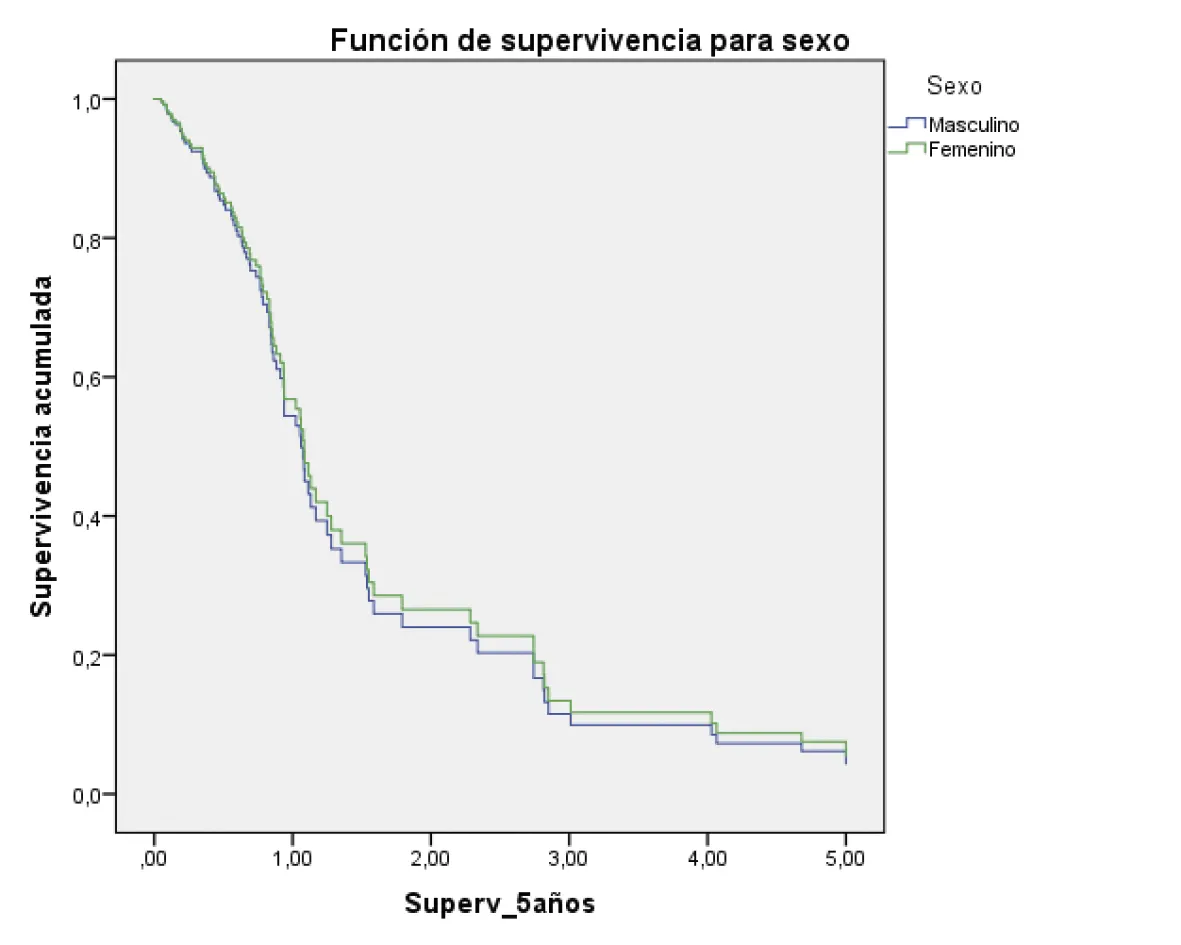
Femenino HR: 1
Masculino (hazard ratio: 0,92; 95% intervalo de confianza = 0,56 – 1,52) P = 0,77
Fuente: preparado por los autores a partir de los resultados.
B
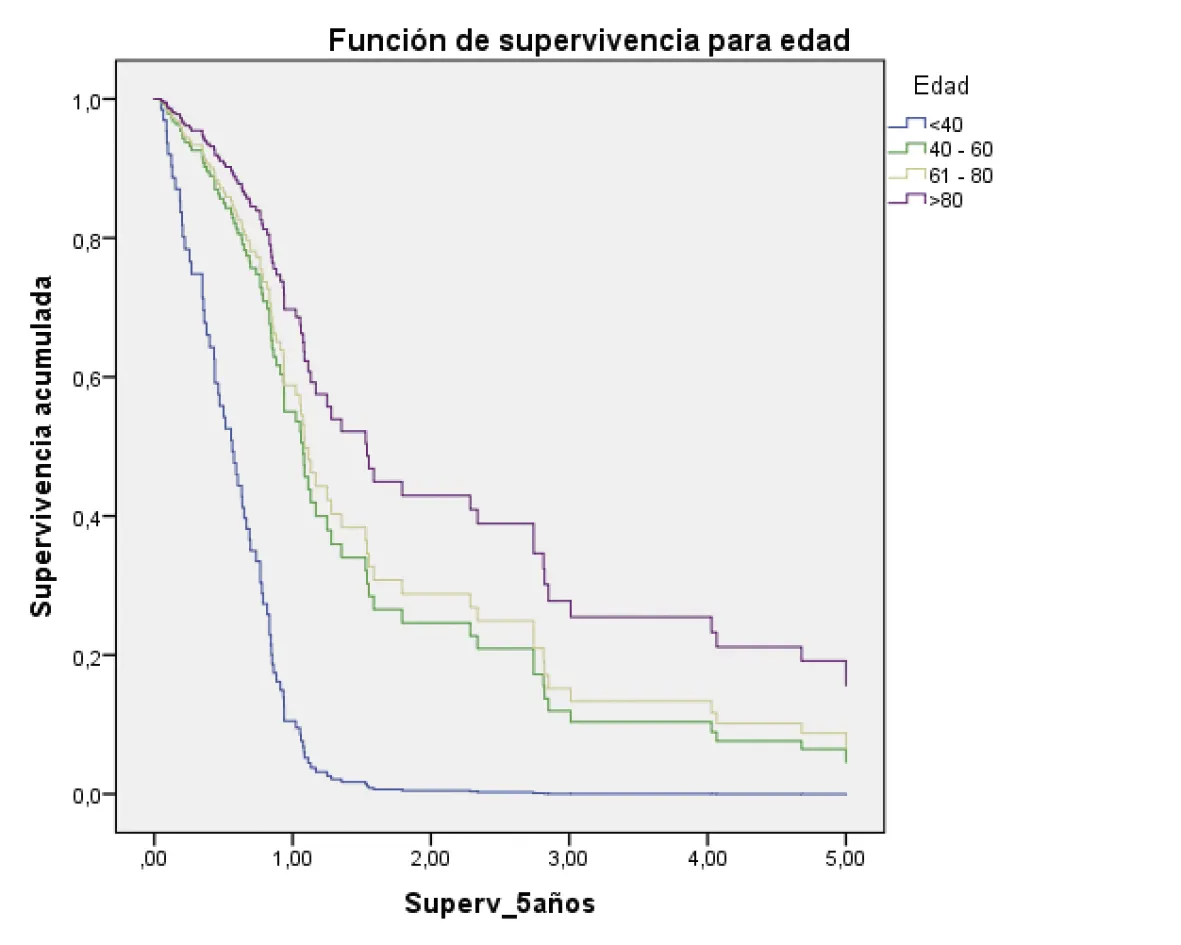
<40: HR: 1
40 -60 (hazard ratio: 0,27; 95% intervalo de confianza = 0,01 – 1,73) p = 0,01
61 -80 (hazard ratio: 0,24; 95% intervalo de confianza = 0,08 – 0,67) p = 0,00
>80 (hazard ratio: 0,16 ; 95% intervalo de confianza = 0,04 – 0,64) ) p = 0,01
Fuente: preparado por los autores a partir de los resultados.
C
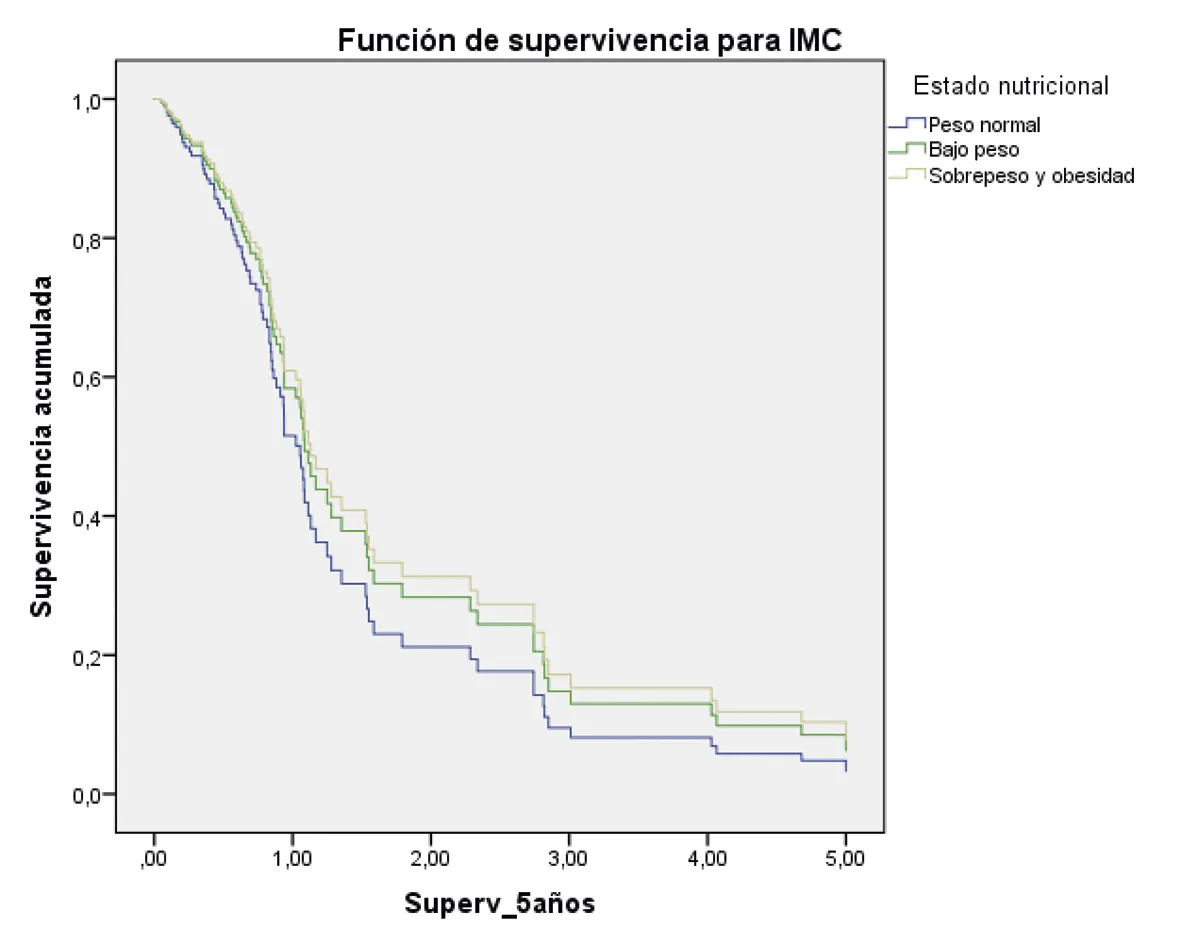
Peso normal: HR 1
Peso bajo (hazard ratio: 0,81; 95% intervalo de confianza = 0,42 – 1,57) p = 0,53
Sobre peso y obesidad (hazard ratio: 0,74; 95% intervalo de confianza = 0,43 – 1,29) p = 0,30
Fuente: preparado por los autores a partir de los resultados.
D
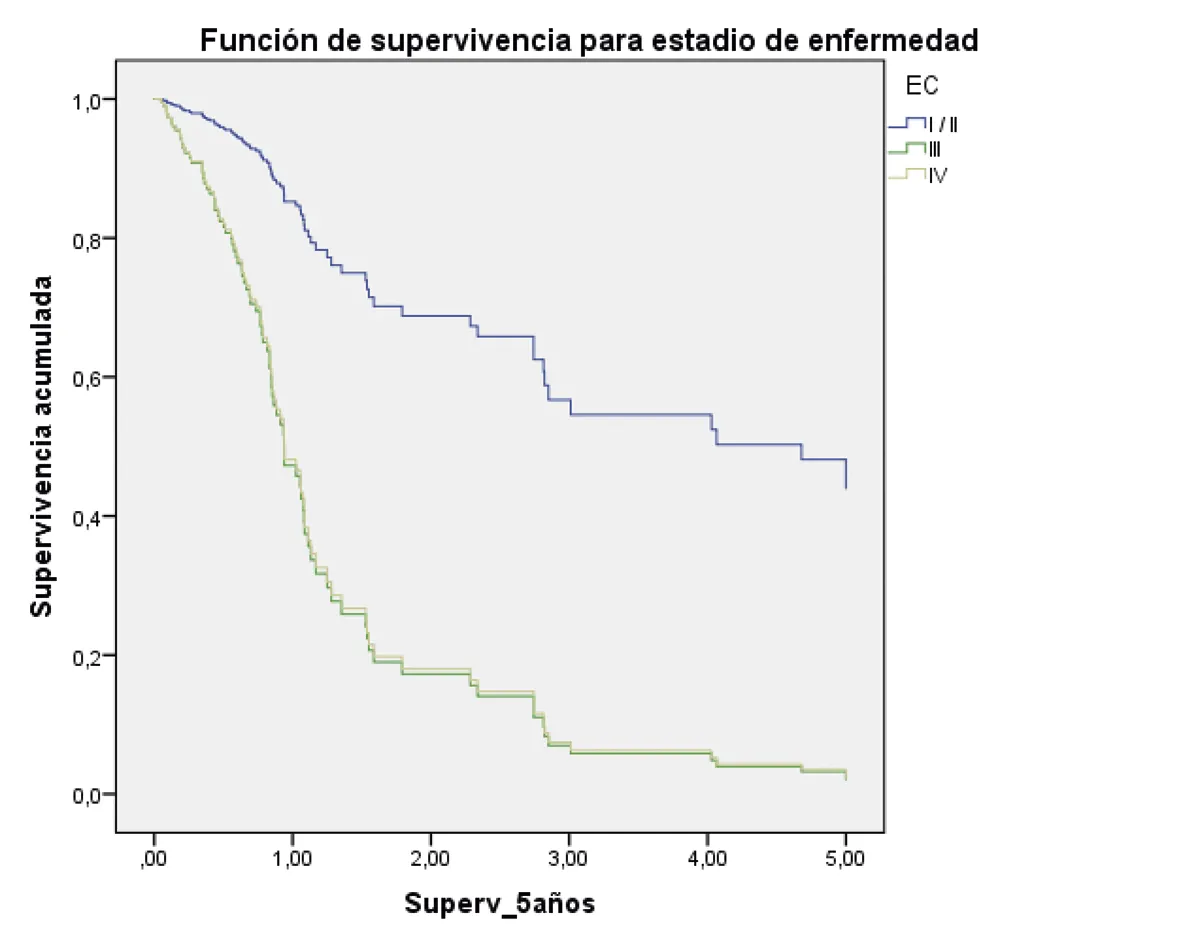
Estadio I-II: HR 1
Estadio III (hazard ratio: 4,69; 95% intervalo de confianza = 1,67 – 13.11) p = 0,00
Estadio IV (hazard ratio: 4,57; 95% intervalo de confianza = 1,50 – 19.92) p = 0,00
Fuente: preparado por los autores a partir de los resultados.
E
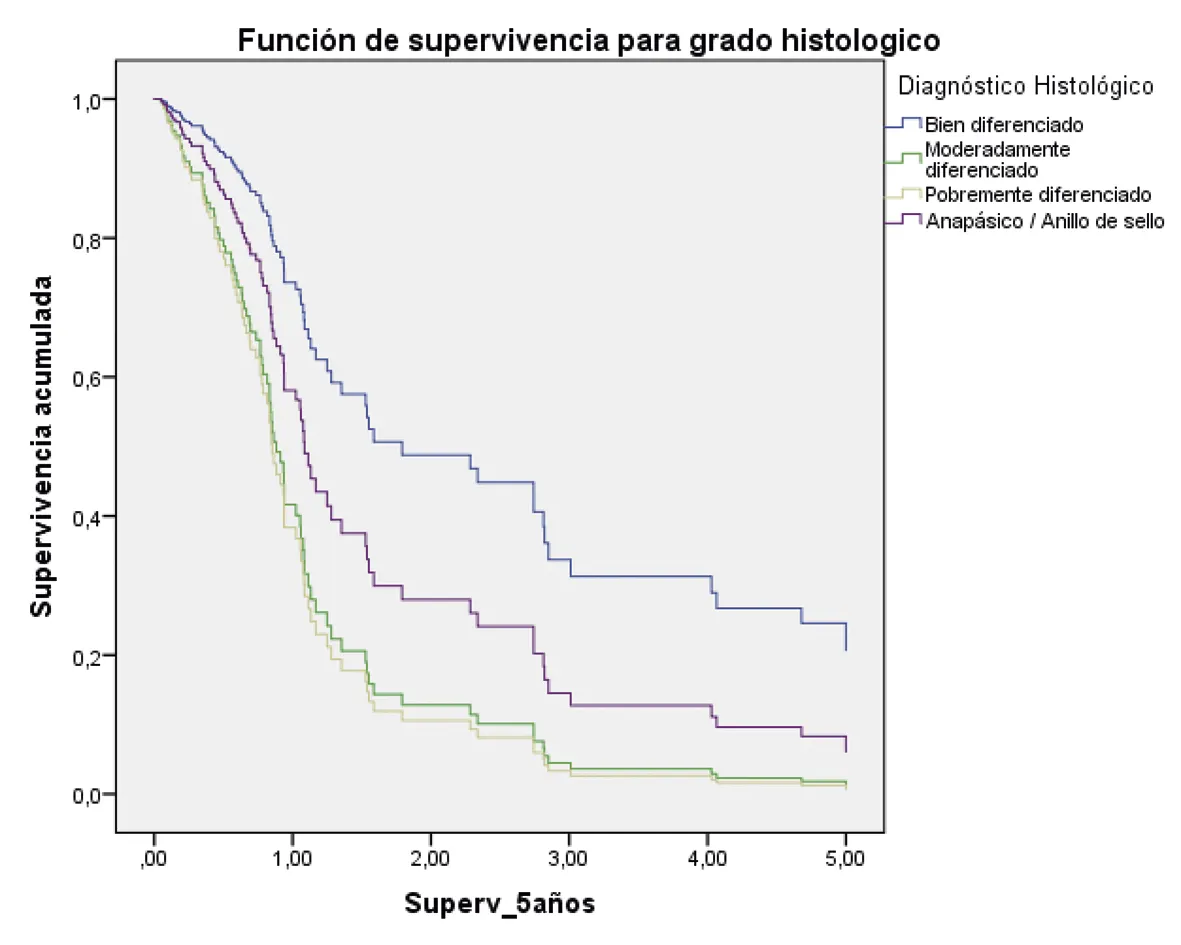
Bien diferenciado: HR 1
Mod. diferenciado(hazard ratio: 2,85; 95% intervalo de confianza = 1,29 – 6.33) p = 0,01
pobremente diferenciado (hazard ratio: 3,12; 95% intervalo de confianza = 1,26 – 7.79) p = 0,01
Anap/Anillo de sello (hazard ratio: 1,77; 95% intervalo de confianza = 0,89 – 3,50) p = 0,09
Fuente: preparado por los autores a partir de los resultados.
F
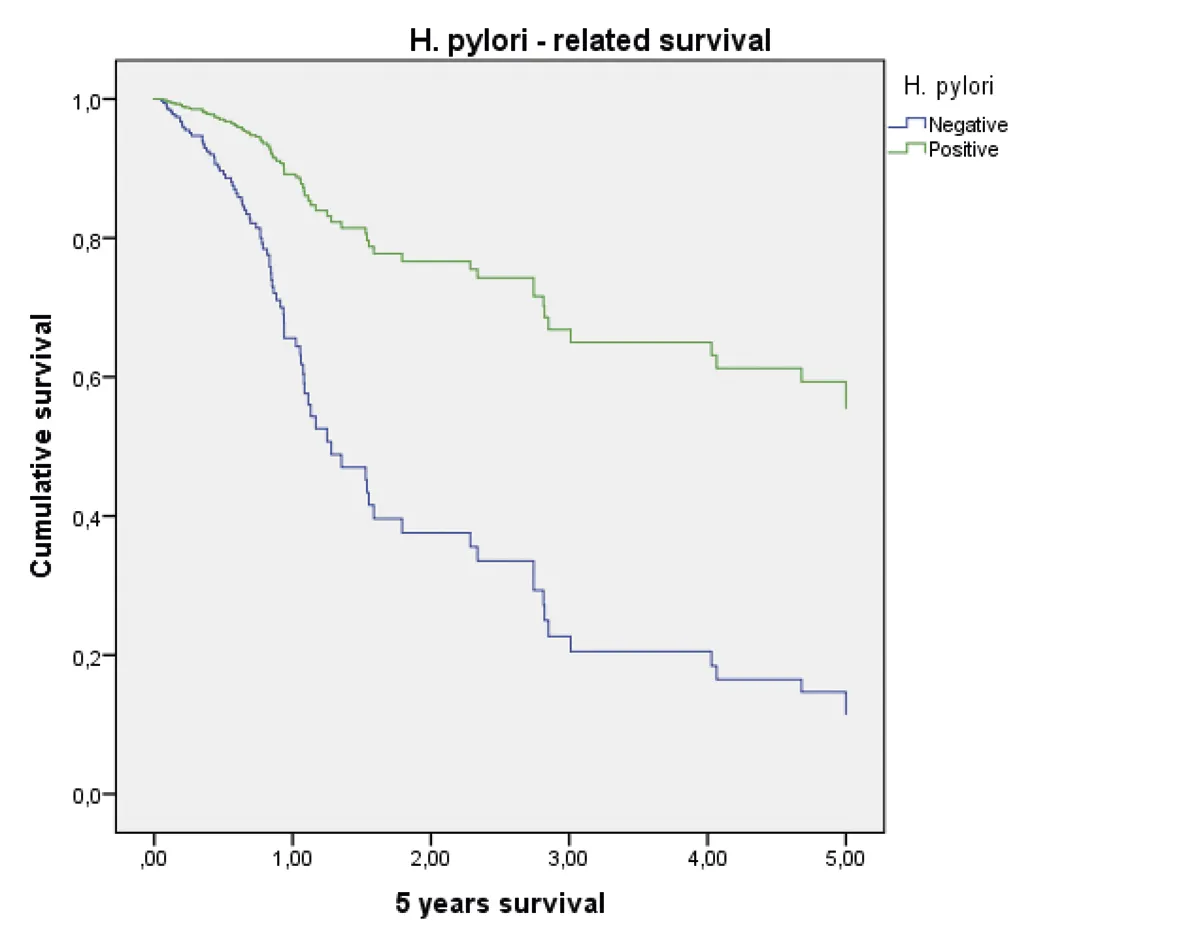
Negativo: HR 1
Positivo (hazard ratio: 0,26; 95% intervalo de confianza = 0,11 – 0,61) p = 0,00
Fuente: preparado por los autores a partir de los resultados.
G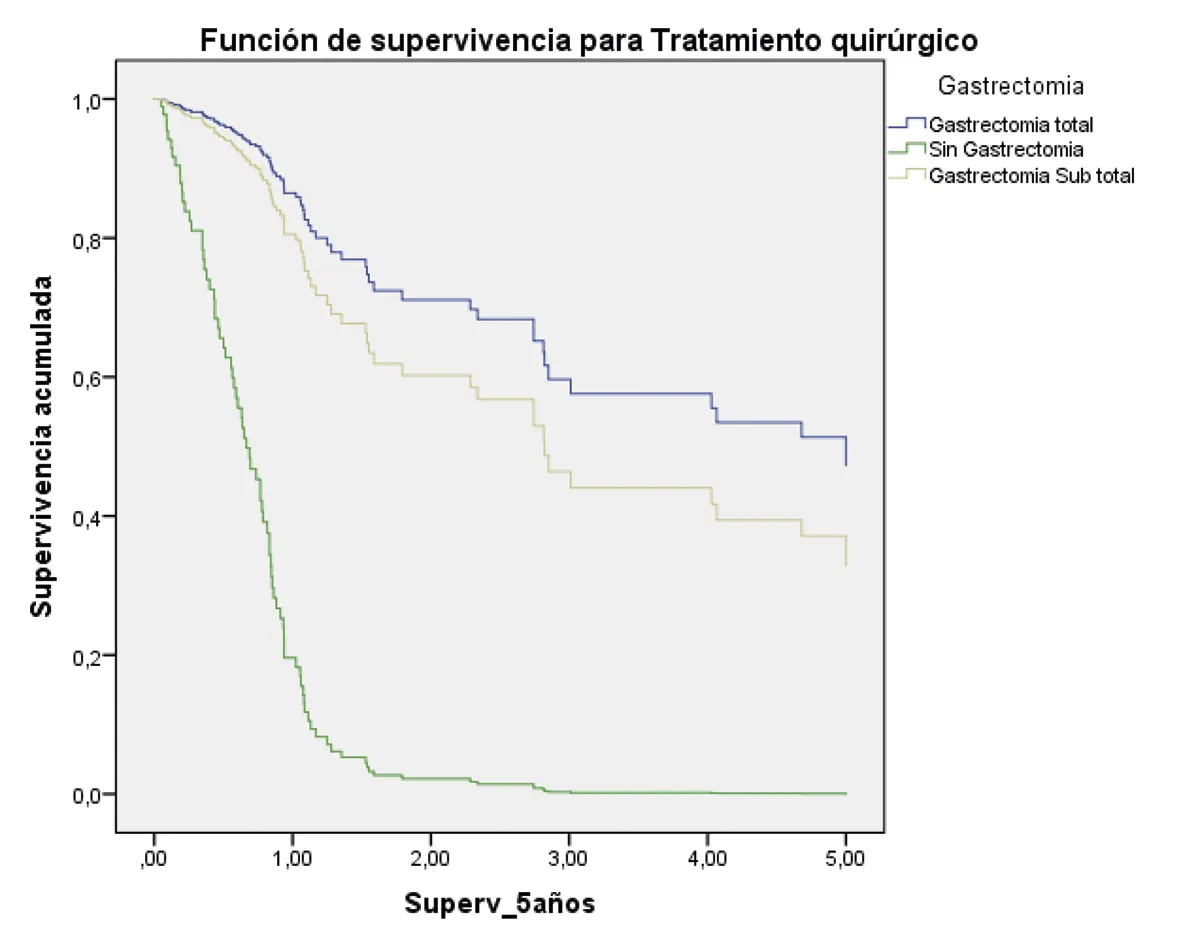
Gastrectomía Total: HR 1
Gastrectomía subtotal (hazard ratio: 1,48; 95% intervalo de confianza = 0,60 – 3,68) p = 0,39
Sin Gastrectomía (hazard ratio: 11.20; 95% intervalo de confianza = 4,67 – 28.85) p = 0,00
Fuente: preparado por los autores a partir de los resultados del estudio.
Figura 2. Supervivencia ajustada a los 5 años de los pacientes con CG. A. Curvas de supervivencia a 5 años en función del sexo; B. En función de la edad; C. En función del estado nutricional; D. En función del estadio; E. En función del diagnóstico histopatológico; F. En función de la presencia de H. pilory; G. En función del tratamiento quirúrgico.
Discusión
Este es el primer estudio en Ecuador que utiliza la base de datos del Registro de Tumores de SOLCA Núcleo de Loja para el análisis de la cohorte de los pacientes con CG. Se concluyó que las variables que influyen negativamente en la supervivencia global son la edad inferior a 40 años, enfermedad avanzada, tumores moderadamente o poco diferenciados y sin abordaje quirúrgico.
Los pacientes menores de 40 años presentaron un riesgo de muerte mayor a los otros rangos de edad estudiados, ya que ninguno de los pacientes sobrevivió hasta los tres años de su diagnóstico. Estos resultados son contrarios a los publicados en varios estudios (12,24,25), pese a la similitud de las tasas de incidencia de CG de otros países: Chile: 13,1; Estambul: 12,6; Alemania: 7,0; Estados Unidos: 4,2, frente a Ecuador, que tiene el 12,55 (23). Sin embargo, en la provincia de Loja, la incidencia en hombres (25,7) y en mujeres (20,0) (26) son equiparables a la del este de Asia 22,4 (27) y han aumentado hasta el 2015 (5).
En un estudio retrospectivo en Estambul, de 866 casos de CA gástrico, se encontró un HR de 1,2 (intervalo de confianza 95%: 1,17 – 1,48, p = 0,03) en los pacientes mayores a 70 años, frente a los menores de 70 años (12). En Chile, otro estudio retrospectivo de 529 pacientes encontró una supervivencia a 5 años de 17,3% en menores de 55 años; 9,9% en el grupo de 55-79 años y 4,2% en los mayores de 80 años (p = 0,006) (24). Finalmente, Hiripi et al., en su estudio de comparación de la supervivencia a 5 años de Alemania y Estados Unidos, encontró una peor supervivencia relacionada con la edad, determinándose en mayores de 85 años supervivencia de 23,5% y 16,2% (p = 0,05), y en pacientes entre 15 a 44 años, de 35,3% y 30,6% (p = 0,002) para Alemania y Estados Unidos, respectivamente (25).
Una posible explicación de nuestros resultados se debe a que los pacientes menores de 40 años acudieron en fases avanzadas de la enfermedad y, además, el tamaño de muestra en este grupo fue considerablemente menor (n = 8) a los otros. Adicionalmente, algunos de los pacientes fueron diagnosticados antes del 2014, periodo durante el cual existía una cancerofobia en la población ecuatoriana, porque los pacientes no acudían a realizar estudios de detección oportuna del cáncer, los tratamientos eran costosos y no eran cubiertos por el Estado ecuatoriano.
A partir del año 2014, el Código Orgánico Monetario y Financiero estableció que las personas que reciban operaciones de crédito (incluidos diferimientos con tarjetas de crédito y otras transacciones crediticias) deberán pagar una contribución del 0,5% del monto total de la operación, quedando exentas de este pago las instituciones del Estado. La misma disposición determinó que los diferentes agentes de retención deben derivar los montos recaudados hacia la Cuenta Única del Tesoro Nacional, y es el Ministerio de Finanzas el que lo reasigna al Ministerio de Salud Pública para que los transfiera de forma trimestral a los diferentes núcleos de SOLCA para la atención gratuita del cáncer. Por esta razón, muchos pacientes, antes del 2014, fallecían en sus domicilios y evitaban acudir a los centros de tratamiento oncológico (SOLCA). Esto derivó en un impacto en la mortalidad de los pacientes con estatus socioeconómico bajo, como se ha demostrado en algunos estudios, los cuales hacen referencia a la influencia de un bajo factor socioeconómico en una mayor mortalidad por cáncer (28,29).
En relación con la influencia del IMC en la supervivencia, el analizar las medianas de supervivencia, el estudio determinó que los pacientes con bajo peso tuvieron una menor probabilidad de supervivencia y los pacientes con sobrepeso/obesidad presentaron una probabilidad de supervivencia a los cinco años mejor que los de peso normal, aunque sin significación estadística.
Resultados similares se publicaron en una investigación que involucró a 18 441 pacientes con CG del China National Cancer Center Gastric Cancer Database, entre 1998-2018, en el que los autores concluyeron que, después de ajustar por factores de confusión, el IMC no influía en el pronóstico (30). Así mismo, en un estudio que comparó la supervivencia en pacientes obesos (n = 205), con peso normal (n = 171) y sobrepeso (n = 125), los autores determinaron que, aunque la recuperación postoperatoria era más difícil en los pacientes obesos, la supervivencia global a largo plazo era similar en los tres grupos (31). Estos datos son contrarios a los reportados en un estudio con 305 pacientes con CG, que determinó que aquellos con bajo peso y obesidad tienen peor supervivencia global (32), y otro estudio retrospectivo en 1868 pacientes que encontró que el IMC y el índice pronóstico nutricional preoperatorios y sus cambios postoperatorios estaban relacionados con el pronóstico, pero únicamente en pacientes con CG en estadios II / III (33).
Finalmente, los resultados de un metaanálisis con 30 642 pacientes indicaron que aquellos con un IMC alto tenían mayor número de complicaciones perioperatorias, independientemente de que sea gastrectomía abierta o laparoscópica, y mayor riesgo de complicaciones postoperatorias en comparación con los pacientes con índice de masa corporal normal o bajo. Sin embargo, un IMC alto no tuvo efecto en la mortalidad postoperatoria y la supervivencia a largo plazo de los pacientes con CG (34).
Por otra parte, encontramos que la supervivencia en los pacientes con CG en estadio I y II fue mejor que en los pacientes en estadio III, y que ninguno de los que tenían estadio IV sobrevivió a cinco años. Otros estudios han mostrado resultados similares en cuanto a que a mayor estadio clínico, menor probabilidad de supervivencia (24,35). Algunos análisis establecen que el diagnóstico temprano del CG constituye un determinante para el tratamiento y que los carcinomas localizados en la mucosa o la submucosa (estadio temprano) tienen un pronóstico mucho más favorable a los cinco años después del diagnóstico. Así, aunque solo el 28% de este tipo de tumor es diagnosticado en la etapa local (temprana), la supervivencia alcanza a ser del 69,9% y disminuye al 31% cuando la enfermedad alcanza una extensión regional, y cae hasta el 4,0% en fase metastásica (4,36,37).
Un estudio previo en Ecuador encontró resultados similares a los nuestros en relación con menor supervivencia en los pacientes en estadio IV en comparación con estadio 0 (p<0.001) (35), pero la supervivencia en sus pacientes al año (72%), tres años (64%) y cinco años (52%) estuvieron muy por encima de las encontrados en nuestro estudio: 29%, 21% y 19%, respectivamente. Una posible explicación es que, en el estudio de Yajamin y colegas, se involucraron pacientes con histologías adicionales, como linfomas, sarcomas y tumores neuroendocrinos, y que el 31% de los pacientes se encontraron en estadios 0 a II, e incluso sin estadificación, lo que podría haber sobrestimado los resultados.
De igual forma, se encontró que los pacientes con histología difusa y pobremente diferenciados presentaron peor pronóstico. Algunos estudios reportaron resultados similares, donde la supervivencia a cinco años fue del 100% para los tumores bien diferenciados, 30% moderadamente diferenciados y 18,2% en los pobremente diferenciados (p = 0,002) (38,39).
Aunque se ha demostrado en múltiples estudios la relación del H. pylori en la génesis del CG (21), el presente estudio determinó que la presencia del patógeno en las muestras de histopatología, al momento del diagnóstico, se relacionó con una mayor supervivencia. Este resultado refuerza la evidencia de que, si bien la infección está relacionada con la patogénesis de la enfermedad, el H. pylori no tiene un papel trascendental en la supervivencia global una vez que se ha establecido el diagnóstico. Kim Y Il y col, en un ensayo clínico, evaluaron la supervivencia de pacientes sometidos o no a tratamiento para H. pylori, posterior a gastrectomía distal por CG, y encontraron que las tasas de supervivencia global (SG) a 5 años fueron del 98,9% en el grupo de tratamiento y del 91,5% en el grupo de placebo, sin diferencias significativas según análisis de Kaplan-Meier (p = 0,957) (40).
Nuestros resultados son contrarios a los reportados por varias publicaciones. Por ejemplo, Liu y cols. analizaron la presencia de infección en 99 pacientes y determinaron que la infección por H. pylori presente en 70 pacientes no solo es el factor principal involucrado en CG, sino que también está involucrada en la invasión y metástasis de CG regulado por la expresión de HPA (heparanase), una enzima que es capaz de degradar el heparán sulfato (HS) en la matriz extracelular (MEC) y la membrana basal, que probablemente esté mediada por la activación de la señalización de MAPK (mitógeno activado por proteína cinasa), que es un factor predictor de peor supervivencia global (p<0,001) y supervivencia sin recaída (p = 0,006), en comparación con los pacientes que no expresan el HPA (41).
Una posible explicación de nuestros hallazgos se debería a la diferencia en el número de pacientes con infección (n = 118) en comparación con aquellos sin infección (n = 13), por lo que sería importante realizar estudios prospectivos con un número equiparable entre los dos grupos de estudio.
El papel de la resección tumoral con enfoque curativo es un factor que influye positivamente en la supervivencia de los pacientes con CG; en nuestro estudio, los pacientes que no fueron manejados con gastrectomía tuvieron un riesgo de muerte 10 veces mayor en comparación con los pacientes sometidos a gastrectomía subtotal (hazard ratio: 11.20 intervalo de confianza 95%: 4,67 – 28.85). Estos resultados son similares a los demostrados en un estudio con 290 pacientes con CG avanzado en donde se evidenció que la supervivencia global de los pacientes sin manejo quirúrgico (6 meses) fue inferior a la de aquellos con manejo quirúrgico gástrico no curativo (15 meses) (p < 0,001) (42).
Por otro lado, en nuestro estudio no encontramos que la supervivencia de los pacientes sometidos a gastrectomía total variara en comparación con los sometidos a gastrectomía subtotal, similar a lo descrito en un metaanálisis que incluyó 1463 pacientes (805 sometidos a gastrectomía subtotal versus 658 con gastrectomía total), en el que los autores determinaron que la supervivencia global a 5 años fue similar entre los grupos 51.6% versus 60.8% con un HR 0,76 (intervalo de confianza 95%: 0,45-1.22) (43). Estos hallazgos son contrarios a los reportados en otro metaanálisis de 5447 pacientes en los que la supervivencia global a 5 años en los pacientes con gastrectomía subtotal versus gastrectomía total fueron 55.9% y 49.6% (riesgo relativo = 0,91 intervalo de confianza 95%: = 0,85-0.97; p = 0,006), respectivamente (44). Los autores concluyeron que, a pesar de encontrar resultados similares en la mortalidad, la gastrectomía total en cánceres gástricos distales mejora la supervivencia global; sin embargo, al ser este un estudio retrospectivo multicéntrico, es necesario realizar análisis prospectivos más extensos.
De igual manera, es necesario mencionar que la investigación actual tiene algunas limitaciones. En primer lugar, al ser de carácter retrospectivo y con base en fuentes secundarias, se tuvieron que excluir a los pacientes sin estudios de imagen para calcular el estadio de la enfermedad. Esta situación se presentó al inicio del periodo evaluado debido a la falta de subsidio por parte del Estado, y los gastos de los análisis y tratamiento corrían por cuenta de los pacientes. No obstante, con su inclusión se podría haber incurrido en sesgo de información en la evaluación de la supervivencia y por eso nuestros resultados son tan robustos como los reportados en estudios previos. Adicionalmente, factores que se han reportado estar asociados con la supervivencia a los 5 años, como la sobreexpresión de HER2 y el esquema de tratamiento de quimioterapia, no se estudiaron puesto que no se miden rutinariamente en el Registro de Tumores SOLCA Núcleo de Loja.
Otra limitación tiene que ver con el tipo de información fuente, porque no fue posible calcular la supervivencia libre de la enfermedad y libre de progresión. No obstante, la información analizada bajo el enfoque de una investigación retrospectiva incluyó los principales factores pronósticos que se ha analizado para estudiar la supervivencia de CG. Por último, en nuestro estudio encontramos que la presencia de H. pylori se relacionó con mejor supervivencia y creemos que, con los pacientes excluidos, pudo haberse eliminado un alto porcentaje de pacientes positivos por H. pylori debido a trabajos realizados en nuestras universidades que sugieren que dicha prevalencia podría variar entre 40.2 y 50%.
Dentro de los aspectos positivos del presente estudio, está el hecho de ser uno de los primeros en la región que analiza la influencia que un amplio espectro de variables tiene en la supervivencia a 5 años en CG; las investigaciones anteriores se han limitado a análisis bivariados. El más reciente es el que se efectuó en la ciudad de Loja respecto a la prevalencia entre el 2018 al 2022, que concluyó que la mayoría de los pacientes eran diagnosticados en estadios III (10.8%) y IV (26.9%), lo que determina un grupo de pacientes con serias limitaciones terapéuticas (45).
Una de las mayores fortalezas es que se utilizaron métodos adecuados para analizarla supervivencia. Además de eso, consideramos que, al ser una investigación inicial en Ecuador, y de esta naturaleza operativa en la región, puede representar una base para futuros estudios multicéntricos en los que quiera evaluarse supervivencia en este tipo de cáncer. Por último, seguimos las guías de STROBE para el reporte adecuado de un estudio de cohorte.
Conclusiones
Los resultados del estudio demuestran una mayor mortalidad asociada con la ausencia de tratamiento quirúrgico, mayor estadio clínico y grados histológicos más agresivos. He aquí la importancia de insistir en la instauración de programas de tamizaje a nivel gubernamental, para detección oportuna de CG, ya que esto mejora las tasas de supervivencia global en poblaciones jóvenes, que, como se demostró, son las más afectadas.
Autoría
Pablo Aldaz-Roldán: Idea, diseño del estudio, recolección de datos, análisis estadístico, interpretación de datos, redacción del borrador del artículo, revisión crítica del artículo, aprobación final de la versión a publicar.
Xavier Astudillo-Romero: Diseño, recolección de datos, análisis estadístico, interpretación de datos, redacción del borrador del artículo, revisión crítica del artículo, aprobación final de la versión a publicar.
Alexis Manrique G: Diseño, recolección de datos, análisis estadístico, interpretación de datos, redacción del borrador del artículo, revisión crítica del artículo, aprobación final de la versión a publicar.
Grace Cambizaca: Diseño, recolección de datos, análisis estadístico, interpretación de datos, redacción del borrador del artículo, revisión crítica del artículo, aprobación final de la versión a publicar.
Diana Marín: Análisis estadístico, interpretación de datos, revisión crítica del artículo, aprobación final de la versión a publicar.
Daniel Aldaz Correa: Idea, diseño del estudio, recolección de datos, análisis estadístico, interpretación de datos.
María Chiriboga Calva: Idea, diseño del estudio, recolección de datos, análisis estadístico, interpretación de datos.
Miriam Encalada Tama: Idea, diseño del estudio, recolección de datos, análisis estadístico, interpretación de datos.
Agradecimientos
Nuestra gratitud a los doctores Nelson Samaniego y Leonardo Castillo por permitir este tipo de investigación en el Hospital SOLCA Núcleo de Loja. De igual forma, nuestro reconocimiento a la Dra. Johanna Castillo Calvas, coordinadora del Registro de Tumores de SOLCA Núcleo de Loja, por facilitar la información, y a la Dra. Patricia Bonilla, decana de la Facultad de Ciencias de la Salud-UTPL, por brindar los recursos logísticos para completar el presente estudio.
Conflictos de intereses
Los autores declaran no presentar conflicto de intereses en la presentación y publicación del presente artículo.
Financiamiento
Estudio financiado por los autores
Aspectos éticos
Esta es una investigación retrospectiva que se basó en datos de historias clínicas del Registro de Tumores SOLCA Núcleo de Loja. No fue necesaria la aprobación por parte de un Comité de Ética de Investigación en Seres Humanos, ya que se trata de un estudio sin riesgos; sin embargo, los autores mantienen los datos asegurados con codificación de pacientes para asegurar su confidencialidad. Los datos recogidos en este trabajo son para uso exclusivo con fines de investigación.
Consentimiento informado
No fue necesario debido a la naturaleza de una investigación operativa.
Disponibilidad de datos
Los datos brutos utilizados para sustentar los hallazgos de este estudio podrán ser divulgados previa solicitud al Registro de Tumores SOLCA-Loja, al que se puede contactar a través del autor de correspondencia o al siguiente correo electrónico: rtumores@solcaloja.med.ec
Referencias
1. International Agency for Research on Cancer. Stomach. (2019). https://gco.iarc.fr/today/data/factsheets/cancers/7-Stomach-fact-sheet.pdf
2. Brenner H, Rothenbacher D, Arndt V. (2009) Epidemiology of stomach cancer. Vol. 472, Methods in Molecular Biology. Methods Mol Biol; p. 467–77. https://pubmed.ncbi.nlm.nih.gov/19107449/
3. Moore MA, Manan AA, Chow KY, Cornain SF, Devi CRB, Triningsih FXE, et al. (2010) Cancer epidemiology and control in peninsular and island South-East Asia – Past, present and future. Vol. 11, Asian Pacific Journal of Cancer Prevention. Asian Pacific Organization for Cancer Prevention;. p. 81–98.
4. American Cancer Society.( 2018) Datos y Estadísticas sobre el Cáncer entre los Hispanos/Latinos 2018-2020. https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/cancer-facts-and-figures-for-hispanics-and-latinos/cancer-facts-and-figures-for-hispanics-and-latinos-2018-2020-spanish.pdf
5. Sociedad de Lucha Contra el Cáncer / Registro Nacional de Tumores. REGISTRO NACIONAL DE TUMORES / NATIONAL CANCER REGISTRY (2010). 15 ed. Cueva, P.; Yépez J, editor. https://issuu.com/solcaquito/docs/epidemiologia_de_cancer_en_quito_20
6. Saito H, Kuroda H, Matsunaga T, Fukuda K, Tatebe S, Tsujitani S, et al. (2010) Prognostic indicators in node-negative advanced gastric cancer patients. J Surg Oncol. 1;101(7):622–5. http://doi.wiley.com/10.1002/jso.21562
7. Yokota T, Kunii Y, Teshima S, Yamada Y, Saito T, Takahashi M, et al. (1999) Significant prognostic factors in patients with node-negative gastric cancer. Int Surg. 84(4):331–6.
8. Yokota T, Ishiyama S, Saito T, Teshima S, Yamada Y, Iwamoto K, Takahashi M, Murata K YH. (2022) Is tumor size a prognostic indicator for gastric carcinoma? – PubMed. https://pubmed.ncbi.nlm.nih.gov/12552975/
9. Shiraishi N, Sato K, Yasuda K, Inomata M, Kitano S. (2007) Multivariate prognostic study on large gastric cancer. J Surg Oncol. 96(1):14–8. https://pubmed.ncbi.nlm.nih.gov/17582596/
10. Tomoda M, Kakeji Y, Maehara Y, Sugimachi K. (1996) Total gastrectomy. Updated operative mortality and long-term survival with particular reference to patients older than 70 years of age. Ann Surg. 224(1):859–62. https://pubmed.ncbi.nlm.nih.gov/8678615/
11. Zeraati H, Amiri Z. (2016) Estimating postoperative survival of gastric cancer patients and factors affecting it in Iran: Based on a TNM-7 Staging System. Acta Med Iran;54(2):114–8. https://pubmed.ncbi.nlm.nih.gov/26997598/
12. Tural D, Selçukbiricik F, Serdengeçti S, Büyükünal E. (2012) A comparison of patient characteristics, prognosis, treatment modalities, and survival according to age group in gastric cancer patients. Vol. 10, World Journal of Surgical Oncology. http://www.wjso.com/content/10/1/234
13. Wang W, Sun Z, Deng J, Wang Z, Zhou Z, Liang H, Xu H. (2016) Integration and analysis of associated data in surgical treatment of gastric cancer based on multicenter, high volume databases) – PubMed. https://pubmed.ncbi.nlm.nih.gov/26831882/
14. Leung WK, Wu M shiang, Kakugawa Y, Kim JJ, Yeoh K guan, Goh KL, et al. (2008) Screening for gastric cancer in Asia: current evidence and practice. Lancet Oncol.;9(3):279–87. https://pubmed.ncbi.nlm.nih.gov/18308253/
15. Alici S, Kaya S, Izmirli M, Tuncer I, Doǧan E, Ozbek H, et al.(2006) Analysis of survival factors in patients with advanced-stage gastric adenocarcinoma. Med Sci Monit [Internet]. 2006 May 1 (cited 2021 Nov 28];12(5). Available from: https://pubmed.ncbi.nlm.nih.gov/16641880/
16. Kuwada K, Kuroda S, Kikuchi S, Yoshida R, Nishizaki M, Kagawa S, et al. (2019) Clinical impact of sarcopenia on gastric cancer. Anticancer Res. 2019;39(5):2241–9.
17. Laurén PA, Nevalainen TJ. (1993) Epidemiology of intestinal and diffuse types of gastric carcinoma a time-trend study in finland with comparison between studies from high- and low-risk areas. Cancer;71(10):2926–33. https://onlinelibrary.wiley.com/doi/10.1002/1097-0142(19930515)71:10%3C2926::AID-CNCR2820711007%3E3.0.CO;2-X
18. Mohar A, Suchil-Bernal L, Hernández-Guerrero A, Podolsky-Rapoport I, Herrera-Goepfert R, Mora-Tiscareño A, et al. (1997) Intestinal type: Diffuse type ratio of gastric carcinoma in a Mexican population. J Exp Clin Cancer Res.;16(2):189–94. Available from: https://pubmed.ncbi.nlm.nih.gov/9261746/
19. Moore JL, Davies AR, Santaolalla A, Van Hemelrijck M, Maisey N, Lagergren J, et al. (2022) Clinical Relevance of the Tumor Location-Modified Laurén Classification System for Gastric Cancer in a Western Population. Ann Surg Oncol. 2022;29(6):3911–20.
20. Qiu MZ, Cai MY, Zhang DS, Wang ZQ, Wang DS, Li YH, et al. (2013) Clinicopathological characteristics and prognostic analysis of Lauren classification in gastric adenocarcinoma in China. J Transl Med.;11(1). https://pubmed.ncbi.nlm.nih.gov/23497313/
21. Sugimoto M, Murata M, Yamaoka Y. (2020) Chemoprevention of gastric cancer development after Helicobacter pylori eradication therapy in an East Asian population: Meta-analysis. World J Gastroenterol. 26(15):1820–40. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7183870/
22. Lee J, Chung SJ, Choi JM, Han YM, Kim JS. (2020) Clinicopathologic characteristics and long-term outcome of gastric cancer patients with family history: Seven-year followup study for Korean health check-up subjects. Gastroenterol Res Pract. 2020; https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7599414/
23. OMS – IARC. Cancer Today. (2020) Estimated age-standardized incidence rates (World) in 2020, all cancers, both sexes, all ages. https://gco.iarc.fr/today/online-analysis-map?v=2020&mode=population&mode_population=continents&population=900&populations=900&key=asr&sex=0&cancer=39&type=0&statistic=5&prevalence=0&population_group=0&ages_group%5B%5D=0&ages_group%5B%5D=17&nb_items=10&gr
24. Heise K, Bertran E, Andia ME, Ferreccio C. (2009) Incidence and survival of stomach cancer in a high-risk population of Chile. World J Gastroenterol. 15(15):1854–62. /pmc/articles/PMC2670413/
25. Hiripi E, Jansen L, Gondos A, Emrich K, Holleczek B, Katalinic A, et al. (2012) Acta Oncologica Survival of stomach and esophagus cancer patients in Germany in the early 21st century. https://www.tandfonline.com/action/journalInformation?journalCode=ionc20
26. Aldaz P, Astudillo D, Castillo J, Padilla F, Pineda R, Alvear R, et al. Patologías Oncológicas de Loja. 1st ed. Vol. 53. EDILOJA; 2019. 1–525 p.
27. International Agency for Research on Cancer. Stomach Globocan 2020 (2020) https://gco.iarc.fr/today/data/factsheets/cancers/7-Stomach-fact-sheet.pdf
28. Singh GK, Jemal A. (2017) Socioeconomic and Racial/Ethnic Disparities in Cancer Mortality, Incidence, and Survival in the United States, 1950-2014: Over Six Decades of Changing Patterns and Widening Inequalities. https://doi.org/10.1155/2017/2819372
29. Exarchakou A, Rachet B, Belot A, Maringe C, Coleman MP. (2018) Impact of national cancer policies on cancer survival trends and socioeconomic inequalities in England, 1996-2013: population based study. BMJ;360:764. http://dx.doi.org/10.1136/bmj.k764
30. Zhao LL, Huang H, Wang Y, Wang TB, Zhou H, Ma FH, et al. (2020) Lifestyle factors and long-term survival of gastric cancer patients: A large bidirectional cohort study from China. World J Gastroenterol;26(14):1613–27. https://pubmed.ncbi.nlm.nih.gov/32327910/
31. Sahakyan MA, Shahbazyan SS, Martirosyan A, Gabrielyan A, Petrosyan H, Sahakyan AM. (2020) Gastrectomy BMI $ 30 kg/m for 2gastric cancer in patients with. Am Surg; 86(2):158–63. Available from: https://pubmed.ncbi.nlm.nih.gov/32106910/
32. Kim EY, Jun KH, Kim SY, Chin HM. (2020) Body mass index and skeletal muscle index are useful prognostic factors for overall survival after gastrectomy for gastric cancer: Retrospective cohort study. Medicine (Baltimore);99(47):e23363. Available from: /pmc/articles/PMC7676598/
33. Park SH, Lee S, Song JH, Choi S, Cho M, Kwon IG, et al. (2020) Prognostic significance of body mass index and prognostic nutritional index in stage II/III gastric cancer. Eur J Surg Oncol;46(4):620–5. https://pubmed.ncbi.nlm.nih.gov/31668977/
34. Zhao B, Zhang J, Mei D, Luo R, Lu H, Xu H, et al. (2018) Does high body mass index negatively affect the surgical outcome and long-term survival of gastric cancer patients who underwent gastrectomy: A systematic review and meta-analysis. Eur J Surg Oncol;44(12):1971–81. https://pubmed.ncbi.nlm.nih.gov/30348605/
35. Yajamín Villamarín RA. (2018) Estudio de supervivencia de cáncer de estómago en pacientes atendidos en la Unidad de Oncología del Hospital SOLCA en el periodo 2010 a 2016. http://repositorio.puce.edu.ec:80/xmlui/handle/22000/15405
36. Instituto Nacional del Cáncer. Cáncer de estómago—Versión para profesionales de salud – Instituto Nacional del Cáncer. 2020. https://www.cancer.gov/espanol/tipos/estomago/pro/prevencion-estomago-pdq#_15
37. SEOM. Cáncer gástrico – SEOM: Sociedad Española de Oncología Médica © 2019 [Internet]. 2019 [cited 2021 Mar 18]. https://seom.org/info-sobre-el-cancer/estomago?showall=1
38. Calik M, Calik I, Demirci E, Altun E, Gundogdu B, Sipal S, et al. Goseki grade and tumour location influence survival of patients with gastric cancer. Asian Pacific J Cancer Prev. 2014;15(3):1429–34. https://pubmed.ncbi.nlm.nih.gov/24606478/
39. De Manzoni, G. Pedrazzani, C. Di Leo, A. Bonfiglio, M. Zerman, G. Tasselli, S. Borzellino G. (2002)[Goseki classification in adenocarcinoma of the cardia] – Minerva Chir; 57(4):449-55. Italian. https://pubmed.ncbi.nlm.nih.gov/12145574/
40. Kim Y Il, Cho SJ, Lee JY, Kim CG, Kook MC, Ryu KW, et al. (2016) Effect of Helicobacter pylori eradication on long-term survival after distal gastrectomy for gastric cancer. Cancer Res Treat ;48(3):1020–9. /pmc/articles/PMC4946357/
41. Liu LP, Sheng XP, Shuai TK, Zhao YX, Li B, Li YM. (2018) Helicobacter pylori promotes invasion and metastasis of gastric cancer by enhancing heparanase expression. World J Gastroenterol;24(40):4565–77. /pmc/articles/PMC6209574/
42. Dittmar Y, Rauchfuss F, Goetz M, Jandt K, Scheuerlein H, Heise M, et al. (2012) Non-curative gastric resection for patients with stage 4 gastric cancer – A single center experience and current review of literature. Vol. 397, Langenbeck’s Archives of Surgery. Langenbecks Arch Surg. p. 745–53. https://pubmed.ncbi.nlm.nih.gov/22307547/
43. Panin SI, Postolov MP, Kovalenko N V., Beburishvili AG, Fedorov A V., Bykov A V. (2020) Sravnitel’naya otsenka subtotal’noi distal’noi rezektsii i gastrektomii v khirurgicheskom lechenie bol’nykh rakom zheludka. Khirurgiia (Sofiia) 18];(11):93–100. https://pubmed.ncbi.nlm.nih.gov/33210514/
44. Qi J, Zhang P, Wang Y, Chen H, Li Y. (2016) Does total gastrectomy provide better outcomes than distal subtotal gastrectomy for distal gastric cancer? A systematic review and meta-analysis. Vol. 11, PLoS ONE. Public Library of Science; 2016 /pmc/articles/PMC5082689/
45. Castro E, Castro N, Albán L, Castro P, Abarca C, Aguirre L, Sócola Z,Ortega R, Aguirre-Reyes D. Cáncer gástrico, una revisión epidemiológicaen tres centros médicos de Loja, Ecuador. Investigación original. Indexia. Abril 2024.
Cómo citar el presente artículo:
Aldaz-Roldán P, Astudillo-Romero X, Manrique A, Cambizaca G, Marín D, Aldaz-Correa D, Chiriboga M, Encalada M. Análisis de supervivencia global a cinco años en pacientes con cáncer gástrico atendidos en la provincia de Loja-Ecuador. Investigación original. Indexia. Agosto 2024.
Todos los artículos se publican bajo la licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0), lo que permite compartir y adaptar el contenido siempre que se dé el crédito adecuado a los autores y a la revista.
