REVISIÓN BIBLIOGRÁFICA
Trastornos menstruales en el hiperandrogenismo
Menstrual disorders in hyperandrogenism
Dra. Ruth Muñoz Apolo 1
1. Departamento de Ginecobstetricia, Hospital Clínica San Agustín, Loja-Ecuador
Palabras Clave: Hiperandrogenismo, anovulación, oligomenorrea.
Keywords: Hyperandrogenism, anovulation, oligomenorrhea.
Fecha recepción: 10-01-2022
Fecha aceptación: 18-03-2022
Fecha publicación: 20-04-2022
DOI: 10.65183/revind.e4.04
Resumen
El trastorno endocrino más relevante causante de trastornos menstruales es el síndrome de ovario poliquístico (SOP), y es sobre el cual versa la siguiente revisión bibliográfica, su importancia radica en que es causante de un cuadro que cursa con Hiperandrogenismo (HA) /Hiperandrogenemia afectando en promedio al 7% de la población, y que puede presentar en la apariencia física: acné, hirsutismo, alopecia; en la menstruación, oligoamenorrea y en la fertilidad oligoanovulación. Se realizó la búsqueda mediante plataformas con contenido especializado como Google Académico, The New England, Jama, Medline, en los cuales se obtiene 1650 artículos, filtrándose 432 por relevancia y 25 como artículos de revisión y textos de biblioteca personal. La etiología es multifactorial, el diagnóstico es por exclusión y el tratamiento a veces no llega a cumplir las expectativas de la paciente, presentando incluso factores de riesgo sugeridos por la obesidad, como son resistencia a la insulina, mayor incidencia de diabetes mellitus tipo II y patrones de lípidos desfavorables. El manejo multienfoque contribuye a mejorar la calidad de vida y sintomatología en las pacientes afectadas con esta patología.
Abstract
The most relevant endocrine disorder causing menstrual disorders is polycystic ovary syndrome (PCOS), which is the subject of the following literature review, its importance lies in the fact that it is the cause of a condition that causes Hyperandrogenism (HA) / Hyperandrogenemia affecting an average of 7% of the population, and can present: in physical appearance: acne, hirsutism, alopecia, in menstruation: oligo-amenorrhea and in fertility: oligo-anovulation. The search was carried out using platforms with specialized content such as Google Scholar, The New England, Jama, 1650 articles were obtained, filtering 432 by relevance and 25 as review articles and personal library texts. The etiology is multifactorial, the diagnosis is by exclusion and the treatment sometimes fails to meet the patient’s expectations, even presenting risk factors suggested by obesity, such as insulin resistance, higher incidence of type II diabetes mellitus and unfavorable lipid patterns. The multi-focus management contributes to improve the quality of life and symptomatology in patients affected with this pathology.
Introducción
El hiperandrogenismo (HA) o exceso de andrógenos es un trastorno endocrino común en las mujeres en edad reproductiva, con una prevalencia del 5-10%, con manifestaciones clínicas, como hirsutismo, acné, alopecia androgénica e incluso virilización. Es de origen probablemente genético e influido por factores ambientales, nutrición y actividad física. Un subgrupo, aquellos tradicionalmente etiquetados como síndrome de ovario poliquístico (SOP), tendrán anovulación, a menudo obesidad y alteraciones menstruales como oligomenorrea, considerando que el 87 % de mujeres con oligomenorrea tendrán SOP.
Métodos
Se realizó la búsqueda mediante plataformas con contenido especializado como Google Académico, The New England, Jama, Medline, Intrame, en español e inglés, se obtuvo 1650 artículos, filtrándose 432 por relevancia y 25 como artículos de revisión y textos de biblioteca personal.
Definiciones
Uno de los síndromes endocrinos hiperandrogénicos más prevalente y que causa alteración menstrual por su exceso de andrógenos es sin duda el SOP, describiéndoselo así:
EL SOP es un trastorno heterogéneo que se define por una combinación de signo y síntomas de exceso de andrógenos (hirsutismo y/o hiperandrogenemia) y disfunción ovárica (oligoanovulación y/o morfología del ovario poliquístico), siempre que se hayan excluido otros diagnósticos específicos, como hiperprolactinemia e hiperplasia suprarrenal congénita no clásica.
Etiología
Es en gran parte desconocida, pero la evidencia actual sugiere que es un trastorno multigénico complejo con fuertes influencias epigenéticas y ambientales, incluidos factores de la dieta y el estilo de vida.¹
Diagnóstico
A lo largo del tiempo, se han propuesto tres diferentes criterios que han ayudado a llegar al diagnóstico de SOP. Cada uno de ellos tiene su validez, y los tres criterios coinciden en que previamente se realice la exclusión de otras patologías específicas que sean causantes de HA de origen periférico, como son hiperplasia suprarrenal congénita (la más común), hiperinsulinemia, insulino-resistencia (IR), tumores funcionantes y otros como la enfermedad de Cushing y el hiper/hipotiroidismo.²
En el año de 1990, el National Institutes of Health (NIH) diagnosticó SOP con la presencia de HA asociado a anovulación crónica y alteraciones menstruales sin otra causa específica de enfermedad adrenal o hipofisiaria que curse con estos síntomas, y sin considerar el aspecto morfológico de los ovarios.³
Criterios de Rotterdam (2003)
En el 2003, en Rotterdam, la Sociedad Europea de Reproducción y Embriología (ESHRE) y la Sociedad Americana de Medicina Reproductiva (ASRM) propusieron unos nuevos criterios para diagnóstico del SOP: 1. Oligoovulación o anovulación, 2. HA clínico y/o bioquímico, 3. Detección ecosonográfica de ovarios morfológicamente poliquísticos.³
Criterios de la Sociedad de Exceso de Andrógenos (AE-PCOS):
Considera la presencia de HA, clínico o bioquímico, (hiperandrogenismo y/o hiperandrogenemia) más uno de los siguientes factores: Oligoanovulación Morfología ecosonográfica de ovarios poliquísticos
Asimismo, las pacientes que presenten por lo menos dos de estos tres criterios serán consideradas diagnosticadas de SOP.
De todos estos criterios diagnósticos anteriores, se pueden establecer los cuatro siguientes fenotipos que tendrán un riesgo metabólico diferente:
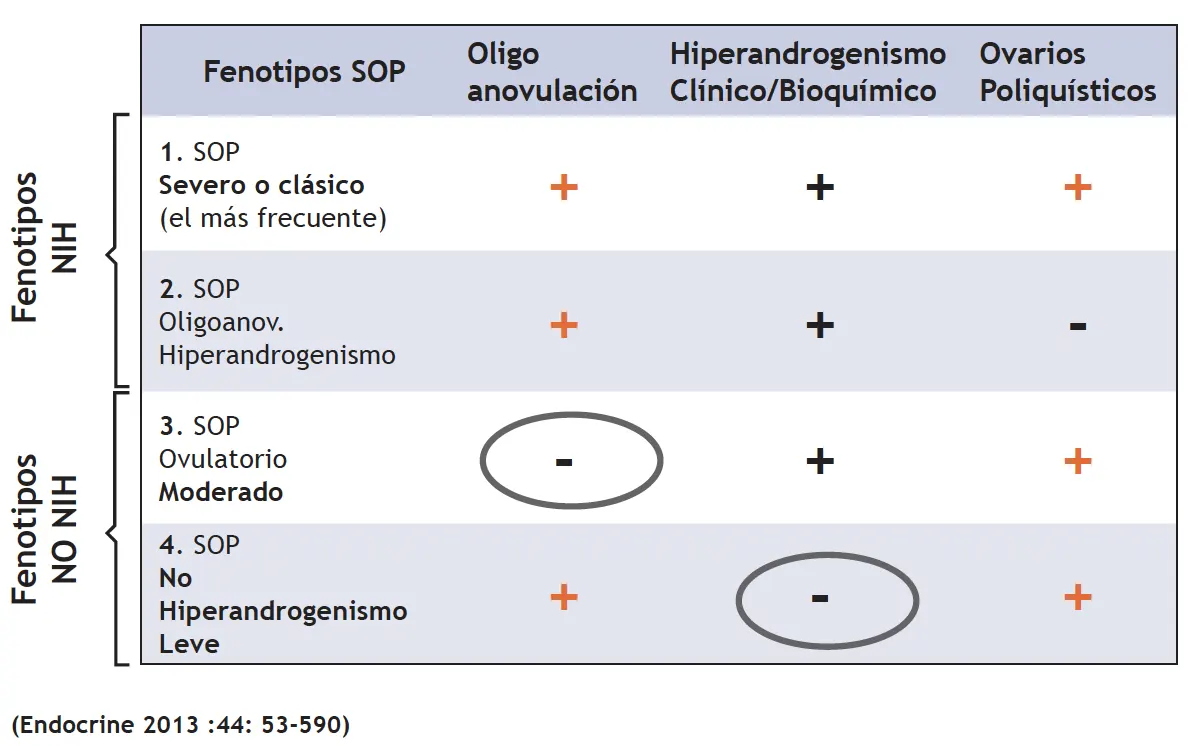
Figura 2.- Sop: Fenotipos y Riesgos
Hiperandrogenismo (HA)
El HA se define como las manifestaciones clínicas derivadas de un exceso o una hipersensibilidad a los andrógenos. Dentro de estas manifestaciones se incluyen el hirsutismo (60-70%), la seborrea, el acné (20-40%) y la alopecia androgénica (2-5%). Un grado extremo de HA lo constituye la virilización, cuadro que es infrecuente en las mujeres con SOP y que es causado principalmente por tumores productores de andrógenos (ováricos o adrenales). La clasificación NIH y Rotterdam aceptaron como criterios diagnósticos de HA el hirsutismo, el acné y la alopecia. Por el contrario, la clasificación de la AES solo acepta como criterio diagnóstico de HA la presencia de hirsutismo⁵.
Los andrógenos son producidos tanto por las glándulas suprarrenales como por los ovarios, a través de un eje de retrocontrol en el que están involucradas hormonas producidas por el hipotálamo y la hipófisis. En este caso, se deben tomar en cuenta las patologías a nivel central
que pueden producir un exceso de hormonas que realicen un retrocontrol positivo en la producción de andrógenos, por ejemplo: la presencia de un prolactinoma, acromegalia o de disfunción hipotalámica, como la dehidroepiandrosterona (DHEA) y el sulfato de dehidroepiandrosterona (DHEAS); dentro de este último, es necesario considerar la hiperplasia suprarrenal congénita no clásica, el síndrome de Cushing y los tumores secretores de andrógenos⁶.
Hay que tener en cuenta, en cambio, que el factor clave para diagnosticar de SOP durante la adolescencia es el HA clínico y bioquímico (hiperandrogenemia)⁷.
Hiperandrogenemia
Los andrógenos son secretados por las gónadas (en la mujer en la teca del ovario) en respuesta a la estimulación de la LH (Hormona Luteinizante) y las glándulas suprarrenales (capa reticular de la suprarrenal) en respuesta a la estimulación de la adrenocorticotrofina
(ACTH), así también se liberan en tejidos no endocrinos, a partir de la conversión de otros precursores circulantes en sangre (piel, hígado, cerebro, grasa) realiza su diagnóstico mediante la cuantificación de los andrógenos circulantes (de los cuales la testosterona libre es la más importante).
Es de mucha ayuda el calcular el índice de andrógenos libres (IAL), la medición de androstenediona y el S-DHEA pueden sumar cada uno con un 10% más de casos con diagnóstico de hiperandrogenemia.
La dosificación de andrógenos junto con la prolactina y FSH ayuda a un mejor diagnóstico cuando hay disfunción menstrual¹.
Causas de Exceso de Andrógenos
El exceso de andrógenos se puede presentar en cinco circunstancias distintas:
- Aumento en la producción endógena: secreción directa por gónadas o suprarrenales o conversión periférica.
- Alteración en el transporte: la disminución de la SHBG (transporta hasta el 78 % de andrógenos) incrementa los niveles de andrógenos en forma libre que normalmente representa el 1-3% de andrógeno circulante.
- Bloqueo de su transformación en estrógenos: carencia de enzima P450 aromatasa.
- Alteración en la respuesta final: aumento de la actividad enzimática de 5 alfa reductasa o aumento en la sensibilidad del receptor de andrógenos.
- Administración de andrógenos exógenos.
Ovarios Poliquísticos
Se define como la visualización ecosonográfica de 12 o más folículos de 2 a 10 mm de diámetro, o un volumen ovárico aumentado de más de 10 ml. Se incluye también como la definición la presencia de folículos antrales de más de 10 mm. Para definir SOP es suficiente que un ovario cumpla el o los criterios anteriormente mencionados y considerar también las siguientes indicaciones:
- No debe utilizarse la apariencia subjetiva de ovarios poliquísticos.
- La distribución de los folículos debe omitirse.
- El aumento de la ecogenicidad o del estroma no se incluyen en la definición.
- Esta definición no es aplicable a mujeres en tratamiento con anticonceptivos hormonales.
Cabe tener en cuenta que la presencia de un ovario morfológicamente poliquístico es un fenómeno fisiológico durante la adolescencia y no se correlaciona con alteraciones endocrinas o metabólicas. Se lo observa en un 30% de adolescentes sanas dentro de los 4 años postmenarquia. Es por este motivo que se recomienda que la morfología de ovario poliquístico no sea un criterio único para definir SOP en las adolescentes⁷.
Alteraciones Menstruales Oligo-Anovoluación
Un ciclo menstrual (CM) normal y regular resulta de la acción coordinada de la ovulación y sus efectos sobre el endometrio, dando una menstruación de duración y cantidad de sangrado normal. La frecuencia normal del CM en una mujer adulta es de 24-38 días en promedio, lo que corresponde al percentil 5 y 95, respectivamente. Se define como oligomenorrea a la presencia de menos de 9 de CM al año o 3 CM de más de 38 días durante el último año, como polimenorrea CM menores de 24 días y como amenorrea CM mayores a 90 días.
La presencia de CM normales en mujeres sin HA puede ser usado como evidencia de ovulación normal. Sin embargo, la presencia de CM regulares en mujeres con HA no asegura la presencia de ovulación, ya que 40% de ellas tienen oligoanovulación cuando son estudiadas con exámenes de laboratorio.
Basados en la evidencia de la falta de relación entre regularidad menstrual y ovulación en mujeres hiperandrogénicas, la AES y el Consenso de Rotterdam sugieren que la presencia de oligoanovulación en estas pacientes debe ser objetivada con la medición de progesterona en los días 20 a 24 del ciclo menstrual. Los criterios del NIH exigen, la presencia de menos de 6 menstruaciones por año.
Los criterios de disfunción ovulatoria no son aplicables en los primeros años posmenarquia. En adolescentes, durante los primeros años después de la menarquia, los ciclos pueden tener una duración de entre 20 a 45 días, un 12% de ciclos ovulatorios al inicio y llegando a un 36% a los 2-3 años de edad ginecológica⁷.
Alteraciones Menstruales
Las alteraciones menstruales constituyen un síntoma constante en el HA y abarca desde oligomenorrea, polimenorrea, metrorragias disfuncionales hasta la amenorrea. En las formas funcionales están presentes en un 75% a 80% de las pacientes siendo característico que se inicien tras la menarca. De estas, entre el 30% y 40% cursan con amenorrea y el 70% con oligomenorrea. En cambio, las pacientes con tumores productores de andrógenos se caracterizan por presentar ciclos menstruales regulares previos y el deterioro es progresivo en poco tiempo. Las alteraciones menstruales son en su mayoría la consecuencia de ciclos anovulatorios y en pocos casos la insuficiencia del cuerpo lúteo. La imposibilidad de gestación está asociada a las alteraciones en los procesos normales de desarrollo folicular, ovulación y formación del cuerpo lúteo.
Fisiopatología:
El SOP es una entidad heterogénea tanto en su cuadro clínico como en su fisiopatología, en la cual no se tiene totalmente determinada su etiología, se ha demostrado varios trastornos relacionados que predisponen al inicio y a la evolución del síndrome y que originan un círculo vicioso en el cual existe una persistente elevación de andrógenos, se ha observado una agregación familiar, aunque en la mayoría de los casos no se encuentra una predisposición genética, los estudios que se han dedicado a ello apoyan a que se trata de un trastorno oligogénico en el que contribuye un número pequeño de genes que se manifiestan en conjunto con factores ambientales, principalmente con obesidad y resistencia a la insulina⁸.
Causas Endocrinas Fisiopatológicas
Relación entre el HA E IR
La hipótesis más firme es una alteración genética a nivel de la serina quinasa, que hace entender que el receptor de insulina y la enzima encargada de la esteroidogénesis se fosforilarían en los residuos serina produciendo IR e hiperandrogenemia, de tal manera que el exceso de andrógenos con HA funcional podría llegar al aumento de la adiposidad abdominal con aumento de citoquinas proinflamatorias y aumento de leptina y disminución de adiponectina, que perpetuarían la IR con hiperinsulinemia que estimularía al ovario para la mayor producción de andrógenos.
El HA cursa con resistencia insulínica con aumento de LDL y disminución de la HDL. La obesidad agrava estos factores y puede ser causa de anovulación crónica mantenida, (Rothenberg et al., 2018) en cambio, la disminución de peso disminuye la insulina y la testosterona libre y aumenta, al mismo tiempo, los niveles de SHBG, produciendo así un cambio en la secreción de gonadotrofinas y, a veces, de esta forma, logra conseguir ovulaciones espontáneas⁹.
Riesgos y Complicaciones del SOP
MANEJO
El objetivo general del tratamiento es poder controlar las manifestaciones clínicas del hiperandrogenismo, como es el acné, reducir el hirsutismo, estabilizar o revertir parcialmente la alopecia androgénica, regular la menstruación, mejorar la fertilidad si se desea, y, en algunos casos, tratar los factores y riesgos asociados a la obesidad.
Los enfoques farmacológicos implican la supresión de los niveles de andrógenos con el uso de un anticonceptivo oral apropiado con efecto antiandrogénico, con el que lograríamos el control de los ciclos menstruales, disminución de los efectos androgénicos sobre la piel y conseguir planificación familiar; o antagonizar la acción de los andrógenos con varios medicamentos que tienen esta actividad. Desafortunadamente, la mayoría de las mujeres con trastornos androgénicos se sienten frustradas en sus esfuerzos por revertir su hiperandrogenismo.
Tratamiento No Farmacológico
REDUCCIÓN DE PESO: El llevar una dieta adecuada con bajo nivel calórico y de grasas, con la presencia de aminoácidos, antioxidantes y vitamina D, junto con actividad aeróbica de al menos 90 minutos a la semana y lograr perder al menos 5% del peso inicial, aumenta la probabilidad de ovulación y embarazo hasta en un 40%, sobre todo si esta pérdida de grasa es a nivel abdominal, si esto fracasa se debe dar como opción la cirugía bariátrica⁶.
La baja de peso es crucial, ya que disminuye el desarrollo de diabetes y el resto de factores causantes de alteraciones cardiovasculares, así como también mejora la calidad de vida, autoestima y depresión.
Tratamiento Sistémico Farmacológico
Debe ser individualizado y se lo prescribirá pensando tanto en la sintomatología, deseo o no de fertilidad, efectos indeseables y tiempo de exposición al fármaco, como también en el factor económico.
El acetato de ciproterona es un inhibidor competitivo de la DHL por su receptor, reduce la actividad de la 5-α reductasa en la piel y simultáneamente reduce la secreción ovárica de andrógenos, por inhibición de la secreción de gonadotrofinas.
La espironolactona es un antagonista puro de la aldosterona usado como diurético; ejerce su efecto en el hiperandrogenismo porque inhibe el citocromo P450c17, necesario para la síntesis de andrógenos a nivel ovárico y suprarrenal. Además, impide la acción de la DHT al ocupar sus receptores.
La flutamida es un antiandrógeno con propiedades no esteroideas, sin acción estrogénica, progestacional, glucocorticoide o antigonadotropa. Su mecanismo de acción periférico, inhibición significativa de la actividad de la 17-20 desmolasa suprarrenal e inhibición selectiva de la secreción de la SDHEA (90-95% de origen suprarrenal) puede producir daño hepático a veces considerable.
El finasteride es un inhibidor selectivo de la 5-α reductasa, que requiere la asociación de anticonceptivos hormonales para el mantenimiento del ciclo. Tiene su indicación fundamental en el hirsutismo idiopático-heredoconstitucional¹⁰.
Discusión
En la presente revisión bibliográfica sobre SOP, se evidencia la necesidad de unificar los criterios para diagnosticar a una paciente como portadora de SOP, en el transcurso del tiempo ha habido 3 criterios para el diagnóstico: el de NIH, el de Rotterdam y la SEA.
Las tres clasificaciones anteriores concuerdan en que ni la presencia de IR, ni el aumento de LH/FSH, ni la presencia de sobrepeso constituyen elementos diagnósticos
del SOP. A su vez, las tres clasificaciones descartan patologías que se puedan confundir con este síndrome.
Los criterios de NIH son los más exigentes y denotan el fenotipo con trastornos metabólicos más severo, considerando que la presencia de HA con ecografía alterada y sin trastorno menstrual también se asocia a trastornos metabólicos a largo plazo, por lo que los criterios de la AES también son adecuados para el diagnóstico del SOP. En cambio, el fenotipo de oligoanovulación y ovario poliquístico a la ecografía sin HA es más discutido.
Conclusiones
El SOP representa una enfermedad con diagnóstico de exclusión, empleando los cuatro fenotipos de Rotterdam, y la tendencia actual es investigar la hormona antimulleriana como predictora de esta enfermedad. Esta hormona es un marcador del número de folículos antrales tempranos ováricos y ofrece una buena potencia diagnóstica, válida cuando no se cuenta con criterio ecosonográfico preciso, podría usarse en lugar de recuento de folículos como criterio de diagnóstico e incorporarse como tal en la definición de Rotterdam de SOP.
El tratamiento está orientado a regular el HA, la menstruación, las alteraciones metabólicas asociadas y la ovulación. Sus alteraciones endocrino-metabólicas muchas veces son sutiles, y las pacientes suelen consultar especialidades en donde, por lo general, se da énfasis solo al motivo de consulta sin llegar al diagnóstico de SOP, perdiéndose la visión global de lo que involucra su diagnóstico.
Muchas mujeres con cambios cutáneos androgénicos cursan con andrógenos séricos normales, lo que sugiere una mayor sensibilidad de los órganos terminales a los andrógenos. Otras tienen hiperandrogenismo (de origen ovárico o suprarrenal). Los cambios en el estilo de vida, la reducción del peso, dieta, ejercicios, medicina alternativa, tratamientos cosméticos, prevención de factores epigenéticos, la terapia quirúrgica y farmacológica contribuyen a mejorar la calidad de vida y sintomatología en las pacientes afectadas con esta patología.
Referencias
- Escobar-Morreale, H. Nature Reviews Endocrinology, Polycystic ovary syndrome: Definition, aetiology, diagnosis and treatment, Vol. 14, 5, 2018, (270-284).
- Rosenfield, R. Ehrmann, D. The Pathogenesis of Polycystic Ovary Syndrome (PCOS): The hypothesis of PCOS as functional ovarian hyperandrogenism revisited, Endocrine Reviews, Vol. 37, 5, 2016, 467-520.
- Suarez C, Becquer H. Borja-Tapia, P. Vela – Chasiluisa, M. Ontaneda, C. Diagnóstico y manejo del síndrome de ovario poliquístico, Recimundo, Vol. 3, 3, 2019, 970-1004.
- Endocrine 2013: 44: 53-590.
- Merino, P. Schulin-zeuthen, C. Codner, E; Nuevas incognitas, 2009, 1071-1080.
- Vega, S. Tratamiento en patologías de ovario poliquístico. Revista Española de Endocrinología de la Universidad Complutense de Madrid., 8 11. Revista, 2015.
- Merino O., Paulina M. Trastornos endocrinos de la pubertad en la niña y adolescente, Revista Médica Clínica Las Condes, vol. 24, 5, 2013, 857-865.
- Médica, Revista. De, Síndrome Poliquístico, 2011.
- Rothenberg, S. Beverley, R. Barnard, E. Baradaran-Shoraka, M. Sanfilippo, J. Polycystic ovary syndrome in adolescents, Best Practice and Research: Clinical Obstetrics and Gynaecology, Vol. 48, 2018, 103-114.
- Saegre. Manual clínico de endocrinología ginecológica y reproductiva. Available from: Vital-Source Bookshelf, Ediciones Journal, 2020.
Cómo citar el presente artículo:
Muñoz R. Trastornos menstruales en el hiperandrogenismo. Revisión Bibliográfica. Indexia. Abril 2022.
Todos los artículos se publican bajo la licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0), lo que permite compartir y adaptar el contenido siempre que se dé el crédito adecuado a los autores y a la revista.
