REVISIÓN BIBLIOGRÁFICA

Estimulación del sistema de conducción: la tecnología en busca de la fisiología
Conduction system pacing: technology in search of physiology
José Apolo 1; Ailema Alemán 2
1., 2. Servicio de Cardiología y Electrofisiología, Hospital Hospital Clínica San Agustín, Loja, Ecuador
Palabras Clave: Estimulacion cardiaca artificial, marcapasos
Keywords: Artificial cardiac stimulation, pacemakers
Fecha recepción: 27-10-2023
Fecha aceptación: 08-12-2023
Fecha publicación: 26-12-2023
DOI: 10.65183/revind.e9.05
Resumen
Los esfuerzos iniciales para estimular artificialmente el corazón surgieron de la necesidad de prevenir eventos bradicárdicos catastróficos. Los primeros sistemas de marcapasos eran dispositivos externos, grandes y voluminosos. La estimulación cardíaca permanente ha evolucionado vertiginosamente desde estos dispositivos externos hasta los marcapasos actuales, versátiles en diseño, de poco peso y multifuncionalidad; por su parte, las indicaciones para el implante de marcapasos han cambiado con el tiempo y abarcan ahora no solo las bradiarritmias, como el bloqueo auriculoventricular y la disfunción sinusal, sino también la terapia de resincronización cardíaca para el manejo de la insuficiencia cardíaca o la terapia eléctrica en el caso de los desfibriladores. Sin embargo, la estimulación cardiaca convencional implica el implante de un marcapasos conectado a un electrodo a nivel de la punta del ventrículo derecho; de este modo, la activación eléctrica de los ventrículos se inicia en el ápex del ventrículo derecho y no siguiendo su trayecto fisiológico, lo que ocasiona disincronía eléctrica y mecánica. La contracción cardíaca asincrónica se ha relacionado con un incremento en la incidencia de arritmias auriculares e insuficiencia cardiaca; por esta razón, en los últimos años la estimulación cardiaca fisiológica es uno de los objetivos que se persigue al implantar un marcapasos. Este tipo de activación del sistema de conducción cardíaco se puede lograr a través de dos técnicas: la estimulación del haz de His y la estimulación del área de la rama izquierda; con ambas se logra recuperar la conducción cardiaca normal y proporcionar un latido sincronizado entre ambos ventrículos.
Abstract
Initial efforts to artificially stimulate the heart arose from the need to prevent catastrophic bradycardic events. Early pacemaker systems were large, bulky, external devices. Permanent cardiac pacing has evolved rapidly from these external devices to current pacemakers, versatile in design, light in weight and multifunctional; besides, indications for pacemaker implantation have changed over time to now cover not only bradyarrhythmias such as atrioventricular block and sinus dysfunction, but also cardiac resynchronization therapy for the management of heart failure or electrical therapy in the case of defibrillators. However, conventional cardiac pacing involves the implantation of a pacemaker connected to an electrode at the apex of the right ventricle, in this way, the electrical activation of the ventricles begins at the apex of the right ventricle and not following its physiological path, which causes electrical and mechanical desynchrony. Asynchronous cardiac contraction has been linked to an increased incidence of atrial arrhythmias and heart failure. For this reason, in recent years, physiological pacing is one of the objectives pursued when implanting a pacemaker. This type of activation of the cardiac conduction system can be achieved through two techniques: His bundle pacing and left bundle branch area pacing, with both of which it is possible to recover normal cardiac conduction and provide a synchronized heartbeat between both ventricles.
Introducción
La enfermedad de la conducción cardíaca es un problema de salud grave causado por el deterioro de la integridad del sistema de conducción; presenta en su fase final la bradiarritmia. Los mecanismos moleculares de la enfermedad de la conducción cardíaca no han sido bien establecidos, e históricamente, durante más de medio siglo, la estimulación desde el ápex del ventrículo derecho (VD) ha sido el enfoque preferido para tratar a estos pacientes. Sin embargo, a pesar de ser un tratamiento efectivo, la estimulación en la punta del VD ha demostrado provocar disincronía eléctrica y mecánica, lo que exacerba el riesgo de fibrilación auricular (FA), insuficiencia cardíaca (IC) e incluso mortalidad (1-4).
Sitios de estimulación miocárdica alternativos, como la del tabique interventricular y la del tracto de salida del VD, han sido evaluados sin evidencia de superioridad sobre la estimulación en ápex (5-7).
Durante los últimos años, la estimulación del sistema de conducción ofrece la capacidad de preservar la activación fisiológica de los ventrículos. El punto originalmente empleado con este propósito fue el haz de His, una técnica efectiva, aunque algo compleja; más recientemente, la activación desde del área de la rama izquierda ha ganado adeptos al contar con una evidencia cada vez mayor de su efectividad y menor dificultad técnica. Fig. 1.
Estimulación del Has de Hiz
Si bien el concepto de estimulación del haz de His existe desde la década de 1960, había una experiencia clínica limitada; no es hasta un estudio realizado por Deshmukh en el año 2000, en 18 pacientes con insuficiencia cardiaca y fibrilación auricular, cuando se recogen datos en relación con la técnica, los resultados agudos y la evolución (8). En un inicio, no se contaba con herramientas específicas para realizar la técnica por lo que una de sus principales limitaciones era conseguir una captura exitosa y estable del haz de His. El desarrollo posterior permitió elaborar herramientas específicas para facilitar el proceso de implante, con lo que la curva de aprendizaje fue siendo menos acusada y los resultados mejores, tanto en el momento agudo como a largo plazo. Por otra parte, múltiples estudios han demostrado los beneficios clínicos de la estimulación del haz de His en mejoría de función, remodelado inverso, reducción de hospitalizaciones y también en mejoría de la calidad de vida (9-11).
Técnica
La estimulación permanente del haz de His se realizó inicialmente utilizando electrodos de estimulación estándar, se moldeaba el estilete o bien se empleaba una vaina ajustable para colocar el electrodo en la zona de His, en un sitio cercano al catéter de mapeo electrofisiológico que marcaba la localización del haz. Este enfoque fue técnicamente desafiante y requería mucho tiempo; sin embargo, el desarrollo de un electrodo de estimulación especializado (SelectSecure 3830, Medtronic, Minneapolis, Minnesota) y vainas (C315His, C304 Select- Site, Medtronic) hicieron factible el empleo de procedimiento en la práctica clínica habitual.
Una vez obtenido el acceso venoso (vena cefálica, axilar o subclavia), se coloca una vaina de 7 Fr sobre una guía corta, luego se avanza la vaina C315 sobre una guía larga, de modo que la punta se acerque al anillo tricuspídeo. Cuando se retira la guía, la vaina tiende a asentarse hacia el anillo cerca de la región del haz de His, y el electrodo de estimulación avanza hacia la punta de la vaina en configuración unipolar; el electrograma del haz de His se puede identificar mientras el cable está todavía dentro de la vaina, la punta de la vaina está en contacto directo con el tejido cardiaco (septo) y permite que la sangre dentro de la vaina actúe como conductora. La punta del electrodo es suavemente empujada hasta la punta de la vaina. Una vez identificado el electrograma de His, se realiza la estimulación a 5V @ 1 ms para asegurar la captura; si no se identifica ningún electrograma His, se puede realizar un mapeo del ritmo para evaluar su captura. Es importante mostrar un ECG de 12 derivaciones durante el mapeo y la estimulación del haz de His, la vaina se sostiene con la mano izquierda y el electrodo de estimulación se gira lentamente en el sentido de las agujas del reloj aproximadamente 5 veces, sin soltar el cable entre rotaciones, para transmitir el torque. Debido a la naturaleza fibrosa de la región hisiana, si el cable está bien anclado, girará hacia atrás en sentido antihorario y, si el cable no está anclado, no retrocederá, incluso si el umbral de captura es aceptable; en esta situación, el umbral aumentará invariablemente antes del final del procedimiento.
La vaina se retira mientras el electrodo se mantiene suavemente hacia adelante hasta que se forma un bucle en la aurícula.
Se realiza el umbral de estimulación con especial atención a la morfología del ECG de 12 derivaciones. Se prefiere probar con un ancho de pulso de 1 ms para permitir un voltaje más bajo, y en la mayoría de los pacientes se acepta un umbral de captura del haz de His de 2,0 V a 1 ms.
Estimulación del área de la rama izquierda
Si bien los resultados técnicos de la estimulación del haz de His han mejorado con el tiempo, al punto de ser considerados como terapia adecuada en pacientes con perspectiva alta de estimulación y como terapia de rescate en pacientes dirigidos a resincronización cardiaca y fallo del implante (11,12), se mantienen ciertas preocupaciones en cuanto a su aplicación clínica en algunos pacientes, principalmente por la complejidad de la técnica, alto umbral de estimulación, amplitudes bajas de la onda R y el riesgo de la evolución del bloqueo a nivel distal del electrodo (10). Con el objetivo de superar los inconvenientes mencionados, las investigaciones se enfocaron en la estimulación del área de la rama izquierda, que intenta preservar la estimulación fisiológica y sincronía cardiaca pero con mayores niveles de seguridad. Los beneficios de esta nueva técnica fueron reportados por primera vez por Huang et al. (13) en pacientes con miocardiopatía dilatada, y posteriormente se han corroborado en varios estudios (14-18).
Técnica
Manteniendo el mismo material de implante de haz de His (Fig. 2) e igual técnica inicial de abordaje venoso y posicionamiento de electrodo y vaina en aurícula derecha, se coloca el electrodo Select Secure 3830 a nivel del haz de His y se avanza en este a nivel del septo interventricular (SIV), aproximadamente 1-2 cm en dirección al ápex cardiaco, realizando una pequeña rotación horaria para superar la válvula tricúspide en vista oblicua anterior derecha (OAD) 30◦, y posteriormente una ligera rotación antihoraria en vista oblicua anterior izquierda (OAI) 30◦ para apoyarse en el SIV.
A este nivel se realiza estimulación con alta salida (5 V) y esta producirá un patrón típico en “W” con una muesca en el nadir del QRS en la derivación V1, una onda R en la derivación II y una forma de onda “RS” o “rS” en la derivación III aparecer (19). Asimismo, la discordancia aVR/aVL (aVR negativo y aVL positivo) se utiliza para determinar el sitio adecuado de anclaje del electrodo (20), luego se rota la vaina en sentido antihorario para garantizar que la punta del cable esté perpendicular a la superficie derecha del SIV y se empuja el electrodo suavemente hacia el lado izquierdo del tabique con movimientos rápidos y repetidos, rotación de tres a cinco vueltas en cada intento de atornillar, después se inyecta contraste a través de la vaina para determinar la profundidad del cable en vista OAI a 30◦. Se debe realizar comprobación periódica de las características del QRS estimulado, así como la impedancia del electrodo para garantizar que este no perfore hasta el ventrículo izquierdo.
El QRS estimulado cambiará de morfología a medida que avance el electrodo a través de la mitad del tabique hacia el lado izquierdo; en la derivación V1, observamos la aparición de un patrón tipo bloqueo de rama derecha con una onda R’, que se cree que representa activación del VD, más tardía en el complejo QRS, cuanto más profundo hacia la izquierda del tabique se avance el cable.
El momento del pico de la onda R en las derivaciones V5 o V6 se cree que representa el tiempo de activación lateral del V1 (19, 20).
Confirmación de correcta estimulación
Para confirmar la captura de la rama izquierda, se realiza estimulación con alta y baja salida, los criterios eléctricos son los siguientes:
- 1. Estrechamiento del complejo QRS (típicamente ≤130 ms) y estimulación morfología del BRD (qR o rSR en la derivación V1).
- 2. El tiempo de activación del V1 desde el estímulo hasta el pico (pLVAT, definido como el intervalo entre el artefacto de estimulación y el pico de la onda R en V5, V6) es <80 ms y constante independientemente del voltaje de estimulación alto (5 V) o bajo (1 V).
- 3. Registrar el potencial de rama izquierda en pacientes sin BRI. Por otro lado, en pacientes con bloqueo de rama izquierda, se puede registrar solo después de la corrección de la conducción de dicho bloqueo.
- 4. Estimulación selectiva o no selectiva de la rama izquierda.
- 5. Registro retrógrado del potencial de His o anterógrado distal de la rama izquierda.
Generalmente, una vez cumplido el criterio 1 y al menos uno de los criterios del 2 al 5, se dice que la captura de la rama izquierda está confirmada, aunque todavía no hay consenso (21).
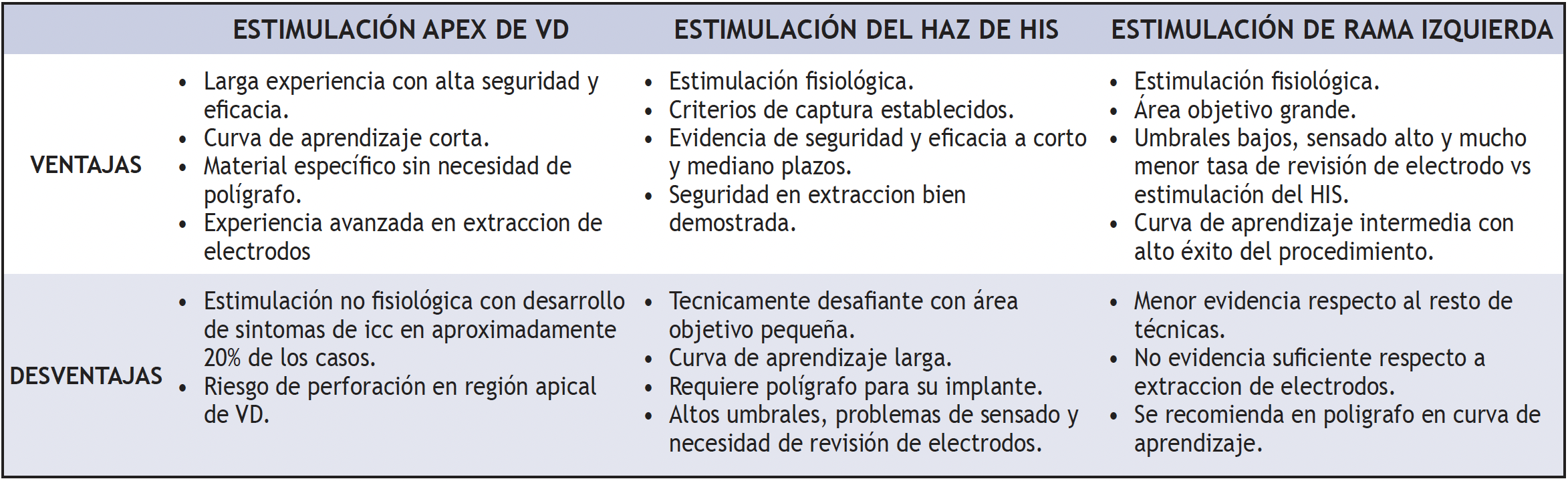
Figura 1. Zona de implante de las 3 ventajas y desventajas de cada técnica
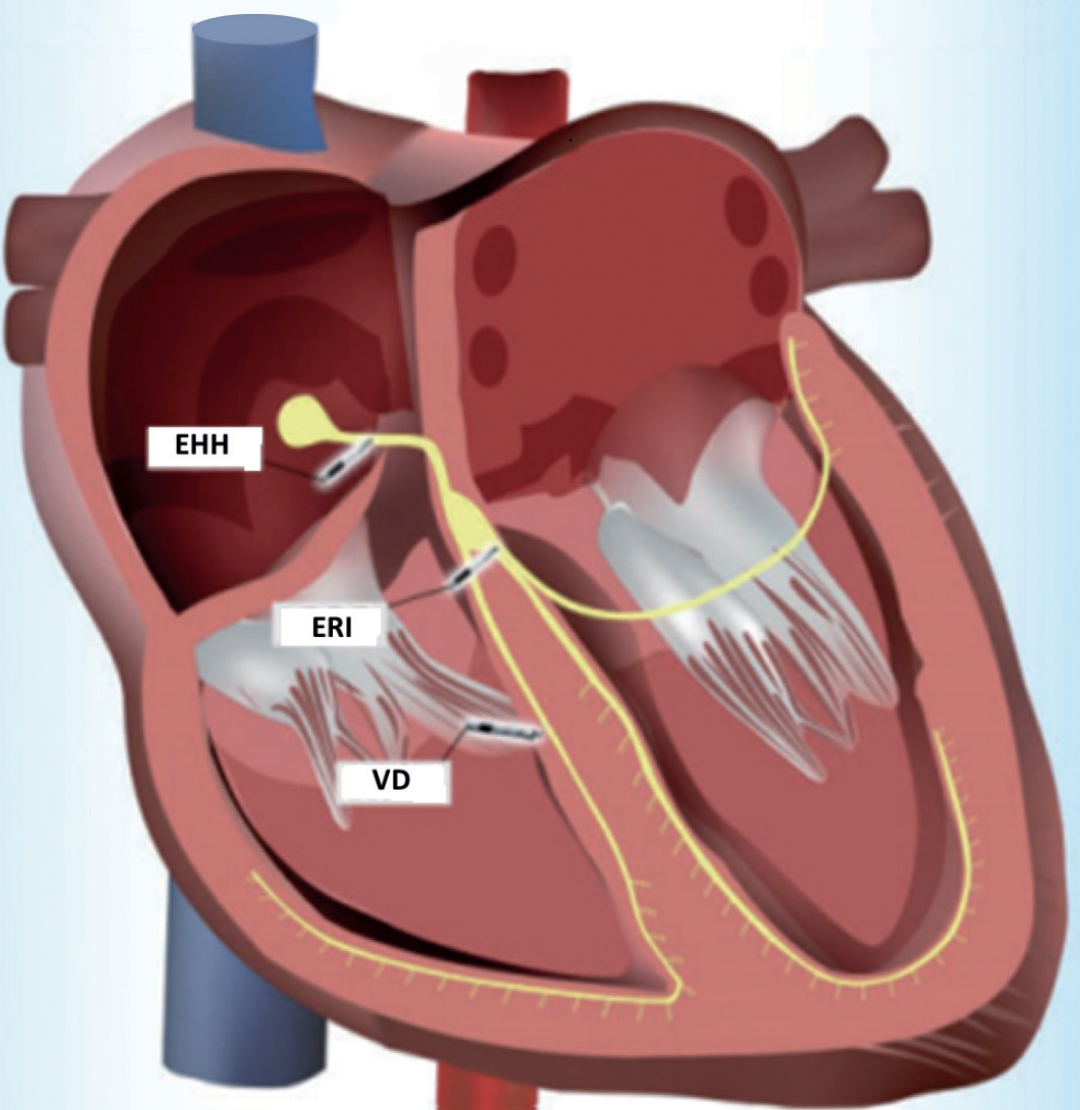
Representación esquemática de estimulación del haz de HIS (EHH), estimulación de rama izquierda (ERI) y estimulación convencional de ventrículo derecho (VD). Para la EHH se introduce por vía transvenosa el electrodo y a nivel basal se busca el área del haz de His, para la ERI el electrodo se dirige a la porción alta del tabique interventricular y se atornilla a su través hasta alcanzar la rama izquierda y la estimulación convencional del VD se realiza con el electrodo en posición septal derecha en general medio-apical.
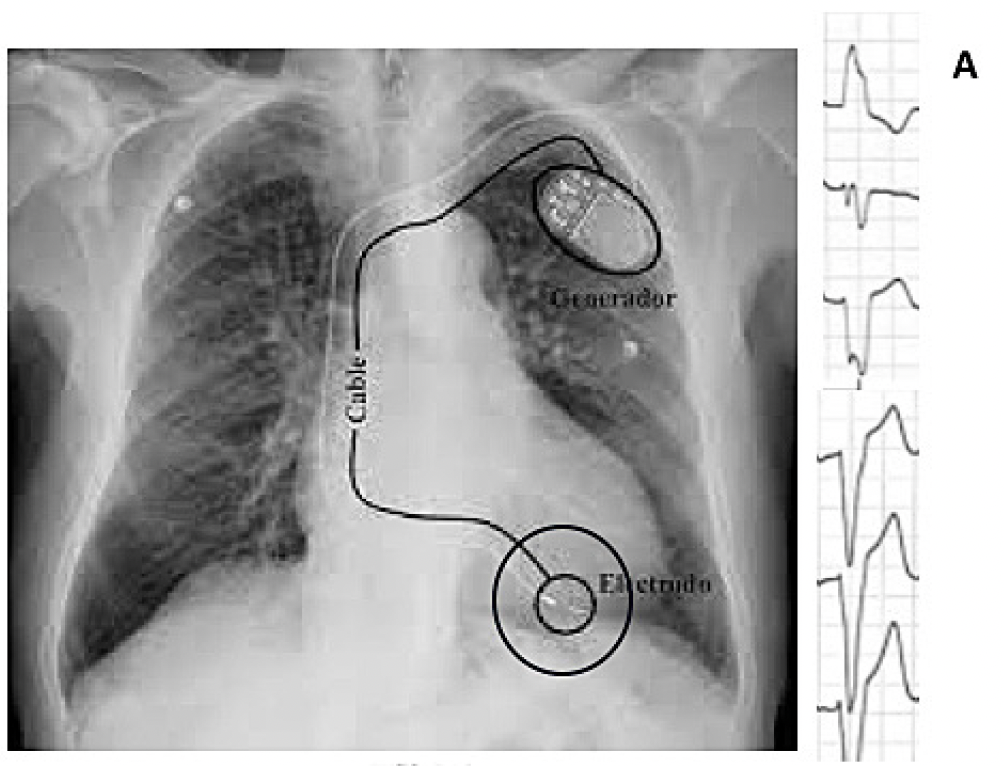
A. Estimulación convencional (punta de VD) con resultado en electrocardiograma de QRS estimulado ancho (asincrono).
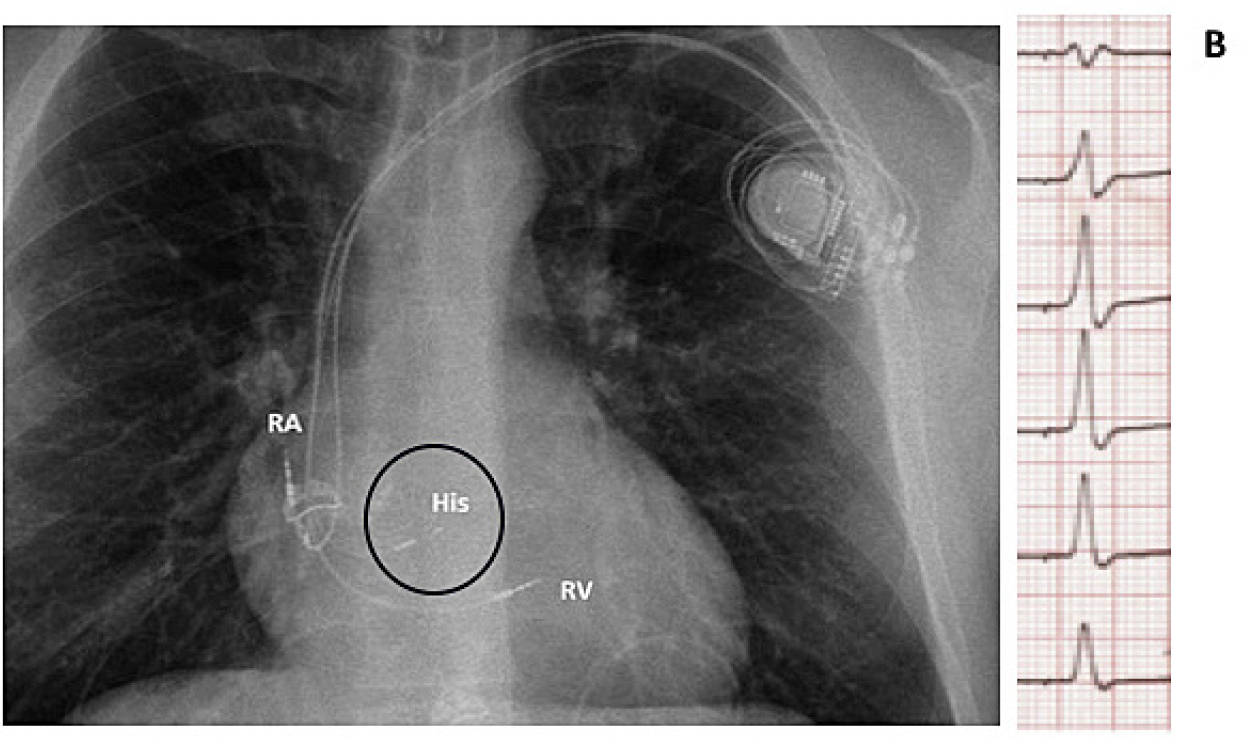
B. Estimulación del haz de His a nivel basal de aurícula derecha justamente sobre el velo septal de la válvula tricúspide con resultado electrocardiográfico óptimo y QRS angosto (fisiológico) y
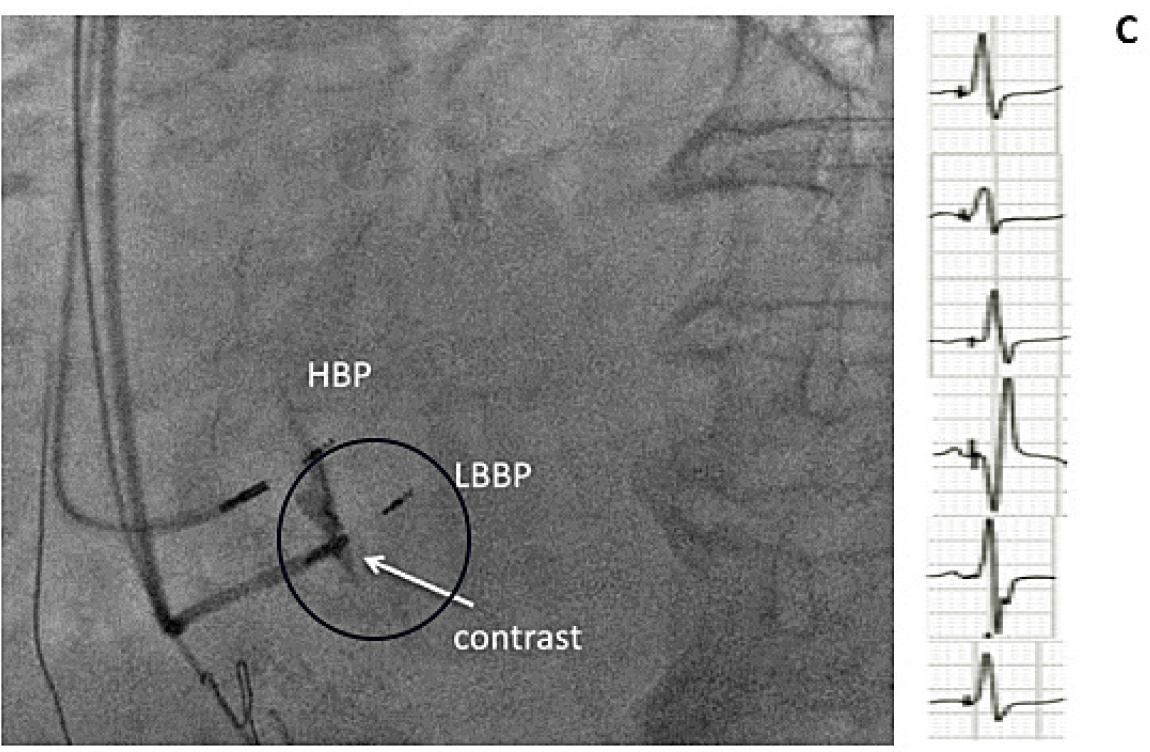
C. Estimulación de rama izquierda se puede observar que se encuentra 1.5-2 mm debajo del His y se utiliza contraste para evaluar la profundidad del electrodo, el electrocardiograma muestra un estímulo fisiológico.
En la tabla 1 se resumen las principales fortalezas y debilidades de las tres técnicas empleadas en el tratamiento antibradicardia, la mayor fortaleza de la estimulación convencional (ápex de VD) es la experiencia de más de medio siglo demostrando su seguridad y eficacia en estabilizar el latido cardiaco. Las nuevas técnicas de estimulación fisiológica se fundamentan no solamente en devolver y estabilizar el latido, sino también en brindar la contracción cardiaca más eficiente posible reactivando el sistema propio de conducción.
Tabla 1. Ventajas y desventajas de las terapias antibradicardia
La estimulación del haz de His (EHH) presenta una curva de aprendizaje más larga que las otras técnicas, necesita del apoyo del polígrafo para la valoración adecuada de señales intracavitarias (His y ventrículo) y se mantienen preocupaciones respecto a una mayor tasa de revisión de electrodos, umbrales elevados en el seguimiento, problemas de detección y agotamiento temprano de batería con necesidad de recambio de generador (22).
Por su parte, la estimulación de la rama izquierda (ERI) presenta una curva de aprendizaje menor, con tasas más altas de éxito del procedimiento, menor riesgo de reintervención, y no es estrictamente necesario el uso del polígrafo, aunque sí es recomendable en los primeros casos hasta una correcta familiarización con la técnica (21). Al presente, parece que esta terapia ha encontrado un equilibrio adecuado tanto en complejidad del implante como en los resultados positivos para el paciente, como se mostrará más adelante; sin embargo, aún la evidencia no es tan sólida como en las otras dos técnicas.
Implicaciones clínicas
Estimulación del Has de Hiz (EHH)
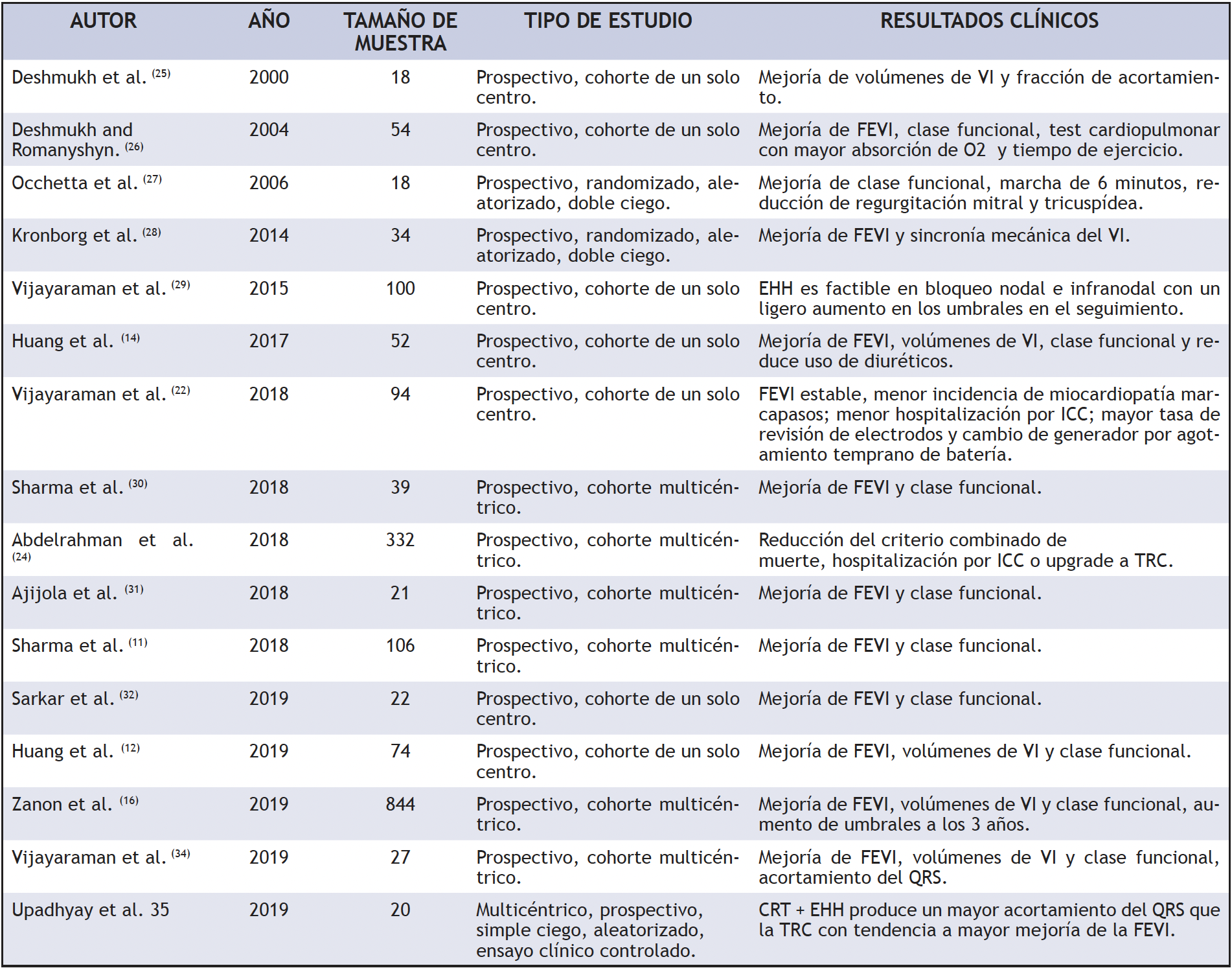
La evidencia sobre diferentes características del implante, éxito del procedimiento, evolución de los parámetros de funcionamiento y lo más importante, las repercusiones clínicas sobre el paciente: clase funcional, fracción de eyección (FEVI), síntomas de insuficiencia cardiaca, arritmias etc., se han descrito en estos últimos años. Zanon et al. (23) reporta un metaanálisis con 26 estudios que incluyen 1438 pacientes, en donde el éxito del procedimiento alcanza el 85%, los umbrales de estimulación promedio fueron 1,71 V en el momento del implante y el promedio FEVI fue de 42,8% al inicio y de 49,5% en el seguimiento.
Abdelrahman et al. (24) presentaron el mayor estudio de cohorte prospectivo que compara la estimulación del haz de His (304 pacientes) vs estimulación en ápex de ventrículo derecho (433 pacientes controles); en este estudio, la EHH se asoció con una disminución del compuesto total de todas las causas de mortalidad, hospitalización por insuficiencia cardiaca y necesidad de upgrade a terapia de resincronización cardiaca en un seguimiento medio de 4.5 años. Cuando se compara la evidencia de otros estudios de seguimiento mayor a 12 meses (tabla 2), existe evidencia considerable que respalda la EHH en la práctica clínica principalmente en pacientes con antecedente de ICC y en los que se espera un porcentaje de estimulación alto (>20%). Por otra parte, existen datos de desempeño a largo plazo de la EHH (5 años), demostrando que, si bien existe mayor revisión de electrodos y umbrales más elevados, el beneficio clínico con reducción de hospitalizaciones por ICC es consistente, incluso en casos de agotamiento temprano de batería (22, 23).
Tabla 2. Evidencia de estimulación del haz de His. ICC: insuficiencia cardiaca congestiva, FEVI: fracción de eyección de ventrículo izquierdo, TRC: terapia de resincronización cardiaca, EHH: estimulación del haz de His
Estimulación del área de la rama izquierda (ERI)
La insuficiencia cardíaca siempre va acompañada de anomalías de conducción, especialmente bloqueo de rama izquierda (BRI) y, de acuerdo a datos epidemiológicos, aproximadamente un tercio de los pacientes con insuficiencia cardíaca tienen un QRS mayor a 120 ms, entre los cuales el 25% tiene BRI (36), en cuanto a la miocardiopatía secundaria a estimulación por marcapasos, el patrón resultante de la estimulación en punta de VD es de BRI o patrones similares, pero siempre con QRS >120 ms.
Aunque la investigación de la ERI se encuentra aún en fase exploratoria, los resultados de esta han sido muy alentadores. El primer grupo en presentar información sobre la ERI fue el de Huang et al. (13), quienes reportaron un caso de miocardiopatía dilatada en una mujer de 72 años con ICC, tratada con ERI luego de implante fallido del haz de His. Al año de seguimiento, encontraron un aumento de la FEVI de un valor inicial de 32 a 62%, reducción del diámetro del VI de 72 mm a 42 mm y mejoría en la clase funcional de estadio IV a I.
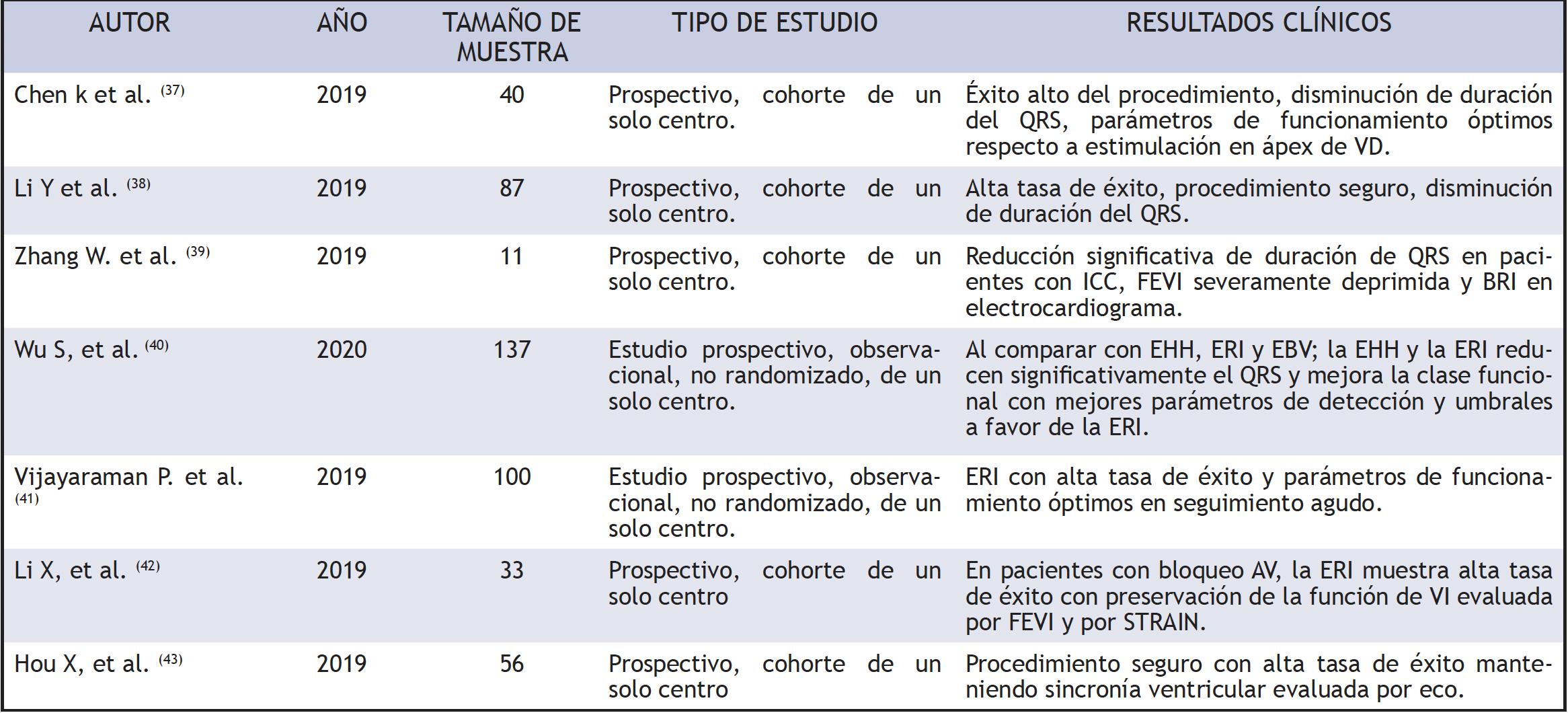
Posteriormente, varios estudios prospectivos han demostrado que la ERI garantiza un estrechamiento significativo del QRS, preservando la sincronía de contracción ventricular, con parámetros de sensado y umbral del electrodo estables y con baja tasa de complicaciones (tabla 3). Chen et al. (37) compararon los parámetros del electrocardiograma entre ERI y estimulación convencional, y encontró una duración de QRS significativamente menor en ERI (111,85 ± 10,77 ms frente a 160,15 ± 15,04 ms, P <0,001), con éxito del procedimiento en 90%; no encontraron diferencias significativas entre los umbrales de estimulación (0,73 ± 0,20 V frente a 0,61± 0,23 V) ni eventos adversos durante el seguimiento de 3 meses. Vijayaraman et al. (41) registraron 93% (93/100) de tasa de éxito de implante de ERI en bradicardia pacientes con BRI, en sus resultados reporta una reducción significativa del QRS frente al inicial (137 ± 19 ms frente a 162 ± 21 ms, P <0,001).
ERI en la insuficiencia cardiaca. Zhang et al. (39) realizaron ERI en 11 pacientes con IC y BRI; se evidenció un acortamiento importante de la duración del QRS después (139,09 ± 17,44 ms vs. 180,00 ± 15,86 ms), mientras que el umbral de estimulación era bajo y estable. Además, los 11 pacientes mostraron una mejoría del 5% en su FEVI, en relación con el valor inicial, en tanto que siete de ellos tuvieron un aumento del 20% en la FEVI y 15% presentó una reducción del diámetro telesistólico ventricular.
Por otra parte, Wu et al. (40) informaron resultados interesantes respecto a la TRC con BRI, en un tratamiento no aleatorizado en el cual compararon ERI, EHH y estimulación biventricular (EBV); se analizaron un total de 137 pacientes con FEVI ≤ 40% y BRI típico remitidos para TRC que recibieron EHH, ERI o EBV, y encontraron media de duración del QRS estimuladas de 100,7 ± 15,3, 110,8 ± 11,1 y 135,4 ± 20,2 ms, respectivamente. Los pacientes del grupo ERI tenían una mayor amplitud de onda R (11,2 ± 5,1 frente a 3,8 ± 1,9 mV) y umbrales de estimulación más bajos (0,49 ± 0,13 V/0,5 ms frente a 1,35 ± 0,73 V/0,5 ms) en relación con los del grupo EHH. En ambos grupos, EHH y ERI mostraron un aumento absoluto similar en FEVI (+23,9 vs. +24%) y tasa de FEVI final normalizada (74,4 frente a 70,0 %) al año de seguimiento.
Seguridad. Desde su descripción, existen bases bien establecidas sobre la seguridad del implante de ERI (37-43), sin embargo, el estudio más representativo hasta la actualidad es el registro europeo multicéntrico MELOS (44). Se trata de una investigación observacional que incluyó pacientes en los que se intentó el implante de ERI en 14 centros europeos; para cualquier indicación, se incluyeron 2.533 pacientes (edad media 73,9 años, mujeres 57,6%, insuficiencia cardíaca 27,5%). El éxito de implante de ERI para indicaciones de bradiarritmia e insuficiencia cardíaca fue del 92,4% y 82,2%, en el orden dado. La curva de aprendizaje fue más pronunciada en los 110 casos iniciales y se estabilizó después de 250 casos. Los predictores independientes de fallo del implante fueron la insuficiencia cardíaca, el QRS basal amplio y el diámetro telediastólico del ventrículo izquierdo. El umbral de captura (0,77 V) y la detección (10,6 mV) se mantuvieron estables durante un seguimiento medio de 6,4 meses. La tasa de complicaciones fue del 11,7%. Adicionalmente, se produjeron complicaciones específicas de la vía transeptal ventricular del cable de estimulación en 209 pacientes (8,3%).
Tabla 3.
Indicaciones actuales
Debido a la evidencia actual y todos los estudios que se mantienen en desarrollo hoy en día, la estimulación fisiológica (EHH y ERI) se encuentra a la altura de la TRC en pacientes con indicación de estimulación cardiaca, FEVI <50% (36-50%) y expectativa de estimulación mayor a 20%, indicación Clase IIa, y en pacientes con ICC, BRI y CF II-IV, tiene el mismo nivel de indicación (IIa) en caso de fallo de intento de implante de TRC convencional (EBV) (45).
Perspectivas futuras
La estimulación del sistema de conducción (fisiológica) ha demostrado y sigue demostrando ser una terapia eficaz, tanto como terapia antibradicardia como en ICC. Las investigaciones respecto a la EHH expusieron sus fortalezas y limitaciones; en el presente se llevan a cabo evaluaciones a muy largo plazo respecto al comportamiento del electrodo en los reemplazos de batería, y también en la necesidad de extracción de este. En cuanto a las limitaciones respecto a umbrales y sensado, así como éxito del procedimiento, se mantienen en desarrollo nuevas herramientas y se ha demostrado que, luego de una curva adecuada de aprendizaje, se llega a una estabilidad en estos parámetros.
Respecto a la ERI, como nueva modalidad de estimulación fisiológica con umbrales estables y bajos, algunos aspectos de esta terapia siguen siendo desconocidos, lo que requiere futuras exploraciones en lo concerniente a la seguridad y eficacia a largo plazo, establecer parámetros para precisar la profundidad del electrodo en el tabique, riesgo real de complicaciones como (perforación septal, embolismo o dislocación del electrodo), o si es posible el implante de un segundo electrodo en caso de fallo del primero, así como también complementar el papel real en pacientes con insuficiencia cardiaca. A pesar del gran potencial de la técnica para efectos fisiológicos de estimulación, se necesita validación adicional mediante estudios con un gran número de participantes y se requieren períodos de seguimiento más prolongados.
Conclusiones
La estimulación del sistema de conducción es una modalidad novedosa que garantiza una disminución en la duración del complejo QRS estimulado, la ERI parece ser la técnica angular a futuro ya que logra superar las limitaciones de la EHH y mantener la seguridad que brinda la estimulación en la punta de ventrículo derecho. La estimulación fisiológica puede actuar como una alternativa a la TRC en pacientes con ICC y BRI. Se espera que, a futuro, se emprendan estudios para validar la seguridad, confiabilidad y desempeño a largo plazo, en donde se utilicen grandes ensayos prospectivos y se afirme su potencial de convertirse en la técnica referente, tanto para la estimulación antibradicardia como para la resincronización cardiaca.
Financiamiento
Los autores no recibieron financiación para el desarrollo de la presente investigación.
Conflicto de interés
Los autores declaran que no existe conflicto de intereses.
Referencias
Wilkoff BL, Cook JR, Epstein AE, Greene HL, Hallstrom AP, Hsia H, et al. Dual-chamber pacing or ventricular backup pacing in patients with an implantable defibrillator: the Dual Chamber and VVI Implantable Defibrillator (DAVID) Trial. JAMA. (2002) 288:3115–23.
Lamas GA, Lee KL, Sweeney MO, Silverman R, Leon A, Yee R, et al. Ventricular pacing or dual-chamber pacing for sinus-node dysfunction. N Engl J Med. (2002) 346:1854–62.
Slotwiner DJ, Raitt MH, Del-Carpio Munoz F, Mulpuru SK, Nasser N, Peterson PN. Impact of physiologic pacing versus right ventricular pacing among patients with left ventricular ejection fraction greater than 35%: a systematic review for the 2018 ACC/AHA/HRS guideline on the evaluation and management of patients with bradycardia and cardiac conduction delay: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. (2019) 140:e483–503.
Sweeney MO, Hellkamp AS, Ellenbogen KA, Greenspon AJ, Freedman RA, Lee KL, et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation. (2003) 107:2932–7.
Zografos TA, Siontis KC, Jastrzebski M, Kutyifa V, Klein HU, Zareba W, et al. Apical vs. non-apical right ventricular pacing in cardiac resynchronization therapy: a meta-analysis. Europace. (2015) 17:1259–66.
Da Costa A, Gabriel L, Romeyer-Bouchard C, Geraldine B, Gate-Martinet A, Laurence B, et al. Focus on right ventricular outflow tract septal pacing. Arch Cardiovasc Dis. (2013) 106:394– 403.
Ng AC, Allman C, Vidaic J, et al. Long-term impact of right ventricular septal versus apical pacing on left ventricular synchrony and function in patients with second-or thirddegree heart block. Am J Cardiol 2009; 103:1096–101.
Deshmukh P, Casavant DA, Romanyshyn M, Anderson K. Permanent, direct His-bundle pacing: a novel approach to cardiac pacing in patients with normal His-Purkinje activation. Circulation. (2000) 101:869–77.
Lustgarten DL, Crespo EM, Arkhipova-Jenkins I, Lobel R, Winget J, Koehler J, et al. His-bundle pacing versus biventricular pacing in cardiac resynchronization therapy patients: a crossover design comparison. Heart Rhythm. (2015) 12:1548–57.
Sharma PS, Ellenbogen KA, Trohman RG. Permanent His Bundle pacing: the past, present, and future. J Cardiovasc Electrophysiol. (2017) 28:458–65.
Sharma PS, Dandamudi G, Herweg B, Wilson D, Singh R, Naperkowski A, et al. Permanent His-bundle pacing as an alternative to biventricular pacing for cardiac resynchronization therapy: a multicenter experience. Heart Rhythm. (2018) 15:413–20.
Huang W, Su L, Wu S, Xu L, Xiao F, Zhou X, et al. Long-term outcomes of His bundle pacing in patients with heart failure with left bundle branch block. Heart. (2019) 105:137–43.
Huang W, Su L, Wu S, Xu L, Xiao F, Zhou X, et al. A novel pacing strategy with low and stable output: pacing the left bundle branch immediately beyond the conduction block. Can J Cardiol. (2017) 33:1736.e1–1736.e3.
Huang W, Su L, Wu S, Xu L, Xiao F, Zhou X, et al. Benefits of permanent His bundle pacing combined with atrioventricular node ablation in atrial fibrillation patients with heart failure with both preserved and reduced left ventricular ejection fraction. J Am Heart Assoc. (2017) 6:e005309. doi: 10.1161/JAHA.116.005309 18.
Chen K, Li Y, Dai Y, Sun Q, Luo B, Li C, et al. Comparison of electrocardiogram characteristics and pacing parameters between left bundle branch pacing and right ventricular pacing in patients receiving pacemaker therapy. Europace. (2019) 21:673–80. doi: 10.1093/europace/ euy252 19.
Li Y, Chen K, Dai Y, Li C, Sun Q, Chen R, et al. Left bundle branch pacing for symptomatic bradycardia: Implant success rate, safety, and pacing characteristics. Heart Rhythm. (2019) 16:1758–65. doi: 10.1016/j.hrthm.2019.05.014 20.
Zhang W, Huang J, Qi Y, Wang F, Guo L, Shi X, et al. Cardiac resynchronization therapy by left bundle branch area pacing in patients with heart failure and left bundle branch block. Heart Rhythm. (2019) 16:1783–90. doi: 10.1016/j.hrthm.2019.09.006 21.
Wu S, Su L, Vijayaraman P, Zheng R, Cai M, Xu L, et al. Left bundle branch pacing for cardiac resynchronization therapy: non-randomized on treatment comparison with His bundle pacing and biventricular pacing. Can J Cardiol. (2020) 37:319–28.
Ponnusamy SS, Arora V, Namboodiri N, Kumar V, Kapoor A, Vijayaraman P. Left bundle branch pacing: a comprehensive review. J Cardiovasc Electrophysiol. (2020) 31:2462–73.
Cano O, Vijayaraman P. Left bundle branch area pacing: implant technique, definitions, outcomes, and complications. Curr Cardiol Rep. (2021) 23:155
Huang W, Chen X, Su L, Wu S, Xia X, Vijayaraman PA. Beginner’s guide to permanent left bundle branch pacing. Heart Rhythm. (2019) 16:1791–6.
Vijayaraman P, Naperkowski A, Subzposh FA, et al. Permanent His-bundle pacing: long-term lead performance and clinical outcomes. Heart Rhythm 2018; 15:696–702.
Zanon F, Ellenbogen KA, Dandamudi G, et al. Permanent His-bundle pacing: a systematic literature review and meta-analysis. Europace 2018; 20:1819–1826.
Abdelrahman M, Subzposh FA, Beer D, et al. Clinical outcomes of His bundle pacing compared to right ventricular pacing. J Am Coll Cardiol 2018; 71:2319–2330.
Deshmukh P, Casavant DA, Romanyshyn M, Anderson K. Permanent, direct His-bundle pacing: a novel approach to cardiac pacing in patients with normal His-Purkinje activation. Circulation 2000; 101:869–877.
Deshmukh PM, Romanyshyn M. Direct His-bundle pacing: present and future. Pacing Clin Electrophysiol 2004; 27(6 Pt 2):862–870.
Occhetta E, Bortnik M, Magnani A, et al. Prevention of ventricular desynchronization by permanent para-Hisian pacing after atrioventricular node ablation in chronic atrial fibrillation: a crossover, blinded, randomized study versus apical right ventricular pacing. J Am Coll Cardiol 2006; 47:1938–1945.
Kronborg MB, Mortensen PT, Poulsen SH, Gerdes JC, Jensen HK, Nielsen JC. His or para-His pacing preserves left ventricular function in atrioventricular block: a double-blind, randomized, crossover study. Europace 2014; 16:1189–1196.
Vijayaraman P, Naperkowski A, Ellenbogen KA, Dandamudi G. Electrophysiologic insights into site of atrioventricular block: lessons from permanent His bundle pacing. JACC Clin Electrophysiol 2015; 1:571–581.
Sharma PS, Naperkowski A, Bauch TD, et al. Permanent His bundle pacing for cardiac resynchronization therapy in patients with heart failure and right bundle branch block. Circ Arrhythm Electrophysiol 2018;11:e006613.
Ajijola OA, Upadhyay GA, Macias C, Shivkumar K, Tung R. Permanent Hisbundle pacing for cardiac resynchronization therapy: initial feasibility study in lieu of left ventricular lead. Heart Rhythm 2017; 14:1353–1361.
Sarkar R, Kaur D, Subramanian M, et al. Permanent His bundle pacing feasibility in routine clinical practice: experience from an Indian center. Indian Heart J 2019; 71:360–363.
Zanon F, Abdelrahman M, Marcantoni L, et al. Long term performance and safety of His bundle pacing: a multicenter experience. J Cardiovasc Electrophysiol 2019; 30:1594–1601.
Vijayaraman P, Herweg B, Ellenbogen KA, Gajek J. His-optimized cardiac resynchronization therapy to maximize electrical resynchronization. Circ Arrhythm Electrophysiol 2019;12:e006934,
Upadhyay GA, Vijayaraman P, Nayak HM, et al. On-treatment comparison between corrective His bundle pacing and biventricular pacing for cardiac resynchronization: a secondary analysis of the His-SYNC Pilot Trial. Heart Rhythm 2019; 16:1797–1807.
Zannad F, Huvelle E, Dickstein K, et al. Left bundle branch block as a risk factor for progression to heart failure. Eur J Heart Fail. (2007) 9:7–14.
Chen K, Li Y, Dai Y, et al. Comparison of electrocardiogram characteristics and pacing parameters between left bundle branch pacing and right ventricular pacing in patients receiving pacemaker therapy. Europace. (2019) 21:673–80.
Li Y, Chen K, Dai Y et al. Left bundle branch pacing for symptomatic bradycardia: Implant success rate, safety, and pacing characteristics. Heart Rhythm. (2019) 16:1758–65.
Zhang W, Huang J, Qi Y et al. Cardiac resynchronization therapy by left bundle branch area pacing in patients with heart failure and left bundle branch block. Heart Rhythm. (2019) 16:1783–90.
Wu S, Su L, Vijayaraman P, Zheng R, Cai M, Xu L, et al. Left bundle branch pacing for cardiac resynchronization therapy: non-randomized on treatment comparison with His bundle pacing and biventricular pacing. Can J Cardiol. (2020) 37:319–28.
Vijayaraman P, Subzposh FA, Naperkowski A, Panikkath R, John K, Mascarenhas V, et al. Prospective evaluation of feasibility and electrophysiologic and echocardiographic characteristics of left bundle branch area pacing. Heart Rhythm. (2019) 16:1774–82.
Li X, Li H, Ma W, Ning X, Liang E, Pang K, et al. Permanent left bundle branch area pacing for atrioventricular block: feasibility, safety, and acute effect. Heart Rhythm. (2019) 16:1766–73.
Hou X, Qian Z, Wang Y, et al. Feasibility and cardiac synchrony of permanent left bundle branch pacing through the interventricular septum. Europace. (2019) 21:1694–702.
Jastrzębski M, Kiełbasa G, Cano O et al. Left bundle branch area pacing outcomes: the multicentre European MELOS study. Eur Heart J. 2022 Oct 21; 43(40):4161-4173.
Chung M, Patton K, Lau Ch, et al. 2023 HRS/APHRS/LAHRS guideline on cardiac physiologic pacing for the avoidance and mitigation of heart failure. Heart Rhythm. 2023 Sep;20(9):e17-e91.
Cómo citar el presente artículo:
Apolo J, Alemán A. Estimulación del sistema de conducción: la tecnología en busca de la fisiología. Revisión bibliográfica. Indexia. Diciembre 2023.
Todos los artículos se publican bajo la licencia Creative Commons Atribución 4.0 Internacional (CC-BY 4.0), lo que permite compartir y adaptar el contenido siempre que se dé el crédito adecuado a los autores y a la revista.
